【改编】研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 |
离子半径(pm) |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
74 |
7.6 |
9.7 |
| Fe3+ |
64 |
2.7 |
3.7 |
| Al3+ |
50 |
3.8 |
4.7 |
| Mn2+ |
80 |
8.3 |
9.8 |
| Pb2+ |
121 |
8.0 |
8.8 |
| Ca2+ |
99 |
- |
- |

请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的离子方程式 。
(2)氧化过程中主要反应的离子方程式为: ,氧化的目的为: 。
(3)在氧化后的液体中加入 ,用于调节pH值,应调节pH的范围为 ,除去的主要离子为: ,吸附步骤除去的主要离子为 。
(4)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
工业上从电解精炼铜的阳极泥(含金、银、铜、硒等单质)中提取硒的湿法工艺流程如下: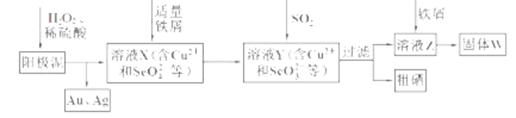
(1)向溶液X中加入铁屑的作用是______ ,此操作中不能加入过量铁粉的原因是______。
(2)检验溶液Z中阴离子的操作方法是______。
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作:______。
(4)实验室中制取SO2的原理为: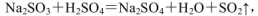 ,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。
,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。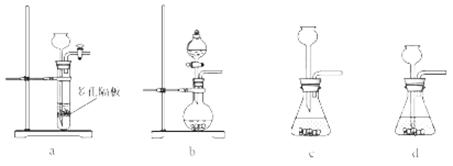
(5)粗硒中硒的含量可用如下方法测定:
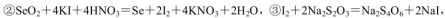 通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol
通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol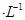 的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为。
的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为。
(12分)【化学——化学与技术】
工业上以黄铁矿为原料,采用接触法生产硫酸。请回答下列问题:
(1)煅烧黄铁矿的设备名称是__________,进料前必须将黄铁矿粉碎,目的是________。所得炉渣的用途有__________________________(填一种用途)。
(2)进入接触室前的气体必须经过净化处理,目的是防止________________________________。
(3)生产过程中,吸收三氧化硫常用的物质是_____________________________。
(4)温度变化与二氧化硫转化率的变化关系可用下图中的曲线______(填“a”或“b”)表示。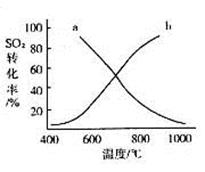
(5)工业上常用熟石灰和硫酸处理、回收尾气中的有害气体。反应的化学方程式为:
________________________________、_________________________________。
(19分)黄铜矿的主要成分是CuFeS2(硫元素显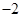 价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下: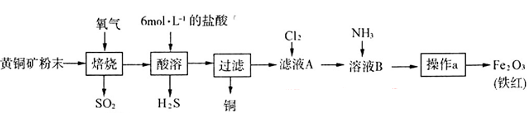
已知: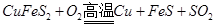
 =
=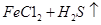
(1)在实验室中,应将黄铜矿粉末放在__________(填仪器名称)中焙烧。
(2)将反应过程中产生的SO2和H2S通入下图所示装置中检验它们的性质。该实验证明SO2具有_________性和__________性。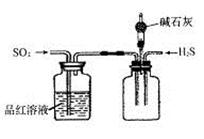
(3)欲选用下列部分装置在实验室中以MnO2和浓盐酸为原料制取纯净、干燥的氯气。 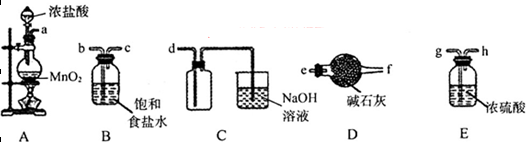
①圆底烧瓶中发生反应的离子方程式为_________________________________________。
②按气流方向由左到右,导管口连接顺序为a→__________________________________。
③装置连接好后,在装药品前,需检验装置的气密性,具体方法是__________________。
④向滤液A中通入C12,某同学取通入C12后的溶液滴加KSCN溶液,用来证明C12的氧化性比Fe3+强的结论。该实验设计是否合理________(填“是”或“否”),请用简要文字解释你的理由_____________________________________________________________。
(4)若使用20 g黄铜矿粉末可制得8 gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是________ (假设各步反应均完全进行且过程中无额外物质损耗)。
(16分)某研究小组拟用粗食盐(含Ca2+、Mg2+、SO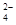 等)、粗硅(含C及不与Cl2反应的固体杂质)制取纯硅,设计如下的工艺流程:
等)、粗硅(含C及不与Cl2反应的固体杂质)制取纯硅,设计如下的工艺流程: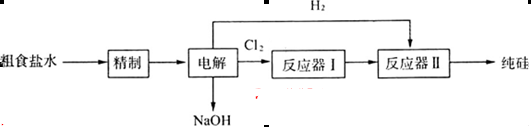
试回答下列问题:
(1)工业上一般是利用过量焦炭在高温下还原石英砂来制取粗硅,写出该过程的化学方程式:_______________________________________________________________________。
(2)精制粗盐水所需试剂为①BaC12;②Na2CO3;③HC1;④NaOH,其滴加的先后顺序是下列的________(填下列各项的序号)。
a.①②④③ b.④②①③ c.④①③② d.②④①③
已知, ,假设该粗盐水中
,假设该粗盐水中 的浓度均为0.01 mol·L-1,若向1 L该粗盐水中逐渐滴入一定量Na2CO3溶液,首先出现的沉淀是__________。
的浓度均为0.01 mol·L-1,若向1 L该粗盐水中逐渐滴入一定量Na2CO3溶液,首先出现的沉淀是__________。
(3)已知SiCl4的沸点是57.6℃,CC14的沸点是76.8℃。在反应器I中得到的SiCl4粗品中含有CCl4,从中得到纯净SiCl4可采用的方法是下列各项中的________(填序号)。
a.蒸馏 b.干馏 c.分液 d.过滤
反应器Ⅱ中发生反应的化学方程式为__________________________________________。
(4)下图是用离子交换膜法电解饱和食盐水的示意图,电解槽中阴极产生的气体是_____。产品A的化学式为____________。
若采用无膜电解槽电解饱和食盐水可制取次氯酸钠,试写出该反应的化学方程式_____。
化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。有机物M(分子式:CxHySz)是隐形飞机上吸波材料的主要成分。
M充分燃烧的产物为三种氧化物,写出化学方程式:______________。
Ⅰ定性实验:
某化学兴趣小组为验证M组成元素进行了下列实验:将少量样品放入燃烧管A中,通入一定量O2,用电炉加热使其燃烧,所需装置如图所示(夹持仪器的装置已略去)。
(1)该实验装置连接顺序为____________________。(上述每一组仪器只能使用一次)
(2)D中盛放的试剂是________
(3)能证明有机物含碳元素的现象是_________________________________________。
(4)燃烧管中放入CuO的作用是________________________________。
(5)指出上述中错误的装置:__________________________________________________。
Ⅱ定量实验:
(1)若测产生CO2气体体积,采用如图所示装置,实验结束后①调整量筒内外液面高度使之相同;②冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:________(请填写步骤代号)。
(2)若测产生CO2气体质量,采用沉淀法。下列沉淀剂最好的是
a.0.1mol/LCaCl2溶液 b.0.1mol/L Ca(OH)2溶液
c.0.1mol/L Ba(NO3)2溶液 d.0.1mol/L Ba(OH)2溶液