工业上从电解精炼铜的阳极泥(含金、银、铜、硒等单质)中提取硒的湿法工艺流程如下: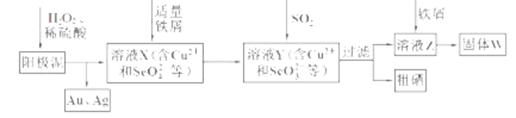
(1)向溶液X中加入铁屑的作用是______ ,此操作中不能加入过量铁粉的原因是______。
(2)检验溶液Z中阴离子的操作方法是______。
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作:______。
(4)实验室中制取SO2的原理为: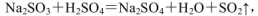 ,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。
,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。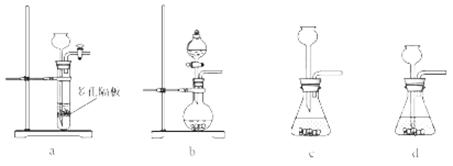
(5)粗硒中硒的含量可用如下方法测定:
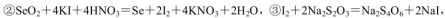 通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol
通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol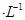 的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 。
的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 。
现在V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20,其中V的一种原子的原子核内没有中子;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍,Y元素原子最外层电子数是X元素原子最外层电子数的两倍;X、Z是金属元素,Z的核外电子排布与Ar原子相同。请回答:
(1)V是,X是,Z是(填元素符号)
(2)Y在周期表中的位置是;
(3)V和W形成V2W型化合物的电子式为,所含的化学键类型为;
(4)用电子式表示Z和Y形成化合物的过程是。
现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素形成的一种化合物为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素符号:B,C;
(2)画出A2-的离子结构示意图:,
指出D在周期表的位置: ;
;
(3)写出B的呈淡黄色的化合物与CO2反应的化学方程式:;
(4)比较D的气态氢化物与H2S和HF的稳定性:(用化学式表示);
(5)用电子式表示C与D形成化合物的过程:。
已知A是灰黑色的硬而脆的固体,B是气态物质,A~E各种物质的相互转化关系如下图所示。
(1)写出B、D、E三种物质的化学式: B ,D ,E ;
B ,D ,E ;
(2)画出A的原子结构示意图 ;
(3)写出C→A的化学方程式 。
除去下列溶液的少量杂质,根据要求填空。
| 物质 |
杂质 |
选用试剂 |
离子方程式 |
| NaNO3 |
NaCl |
||
| KCl |
K2CO3 |
||
| NaHCO3 |
Na2CO3 |
将过量的SO2分别通入下列溶液:①氢硫酸②溴水③品红溶液④澄清石灰水⑤酸性高锰酸钾⑥氯化钙溶液,根据要求填空。
(1)无明显现象的是;
(2 )溶液颜色褪去的是;
)溶液颜色褪去的是;
(3)SO2作氧化剂的是;
(4)SO2作还原剂的是;
(5)先生成沉淀然后沉淀溶解的是;
(6)有沉淀生成且沉淀不溶解的是。