将过量的SO2分别通入下列溶液:①氢硫酸②溴水③品红溶液④澄清石灰水⑤酸性高锰酸钾⑥氯化钙溶液,根据要求填空。
(1)无明显现象的是 ;
(2 )溶液颜色褪去的是 ;
)溶液颜色褪去的是 ;
(3)SO2作氧化剂的是 ;
(4)SO2作还原剂的是 ;
(5)先生成沉淀然后沉淀溶解的是 ;
(6)有沉淀生成且沉淀不溶解的是 。
某化学课外小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题。可供选择的试剂有:
| A.大理石 | B.盐酸 | C.氢氧化钠溶液 | D.澄清石灰水。三名同学设计的制备实验方案的反应流程分别如下: |
甲:NaOH溶液 Na2CO3溶液
Na2CO3溶液
乙:NaOH溶液 NaHCO3溶液
NaHCO3溶液 Na2CO3固体
Na2CO3固体 Na2CO3溶液
Na2CO3溶液
丙:NaOH溶液 NaHCO3溶液
NaHCO3溶液 Na2CO3溶液
Na2CO3溶液
请完成下列问题:
(1)请指出甲、乙两方案的主要缺点:
甲方案_______________________________________。
乙方案_______________________________________。
(2)若采用丙方案制取纯Na2CO3溶液,其实验的关键有________________。
(3)假设反应③所得的NaHCO3溶液中含有Na2CO3。现要利用A~D四种试剂证明Na2CO3的存在,你所选择的试剂有_________________(填试剂代号在题干中)。
(4)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3。乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学能否达到实验目的?(填“能”或“不能”)。若能,请说明其计算需要的数据;若不能,请简要说明理由。
_____________________________________。
(12分)如图,把1体积CH4和4体积Cl2组成的混合气体充入大试管中,将此试管倒立在盛Na2SiO3溶液的水槽里,放在光亮处。片刻后发现试管中气体颜色_______________,试管中的液面___________,试管壁上有_____________出现,还观察到水槽中______________。
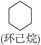
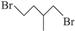
(15分)环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂)。
| 结构简式 |
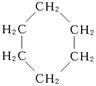 |
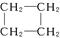 |
Br—CH2—CH2— CH(CH3) —CH2—Br |
| 键线式 |
 |
 |
 |
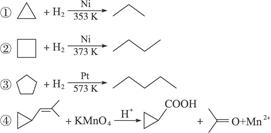
请完成下列问题:
(1)环烷烃与______________是同分异构体。
(2)从反应①—③可以看出,最容易发生开环加成反应的环烷烃是______________(填名称)。判断依据为____________________________________________________________________。
(3)环烷烃还可以与卤素单质、卤化氢发生类似的开环加成反应,如环丁烷与HBr在一定条件下反应,其化学方程式为______________________(不需注明反应条件)。
(4)写出鉴别环丙烷和丙烯的一种方法。所用试剂是______________;现象与结论是___________________________________________________________________________。
(8分)现有四种烃:①C2H6 ②C2H4 ③C2H2 ④C6H5CH3
(1)易发生取代反应的烃是(填序号,下同) ___________,易发生加成反应的是___________。
(2)碳碳键的键长由长到短的顺序为___________。
(3)在空气中燃烧时,能产生浓烟的是___________,其原因是___________。
(4)将其通入(或滴入)KMnO4酸性溶液中,能使之褪色的有______________________。
(5)③与HCl的反应产物在一定条件下合成高分子化合物的反应方程式为________________。
(6)④与浓H2SO4、浓HNO3反应生成TNT的化学方程式为____________________________。
(8分)某烃A 0.2 mol在氧气中充分燃烧后,生成化合物B、C各1.2 mol,试完成下列问题:
(1)烃A的分子式是_________。
(2)若取一定量的烃A充分燃烧后,生成B、C各3 mol,则有_________g的A参加了反应,燃烧时消耗标准状况下的氧气_________ L。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式是___________。
(4)若烃A能使溴水褪色,在催化剂作用下与H2发生加成反应后生成2,2-二甲基丁烷,则烃A的名称是_________,结构简式是_________。
(5)比A少两个碳原子的A的烯烃同系物的同分异构体共有_________种。