(16分)某研究小组拟用粗食盐(含Ca2+、Mg2+、SO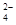 等)、粗硅(含C及不与Cl2反应的固体杂质)制取纯硅,设计如下的工艺流程:
等)、粗硅(含C及不与Cl2反应的固体杂质)制取纯硅,设计如下的工艺流程: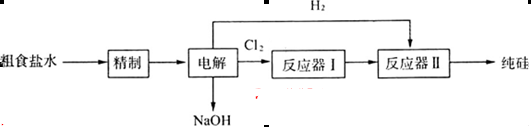
试回答下列问题:
(1)工业上一般是利用过量焦炭在高温下还原石英砂来制取粗硅,写出该过程的化学方程式:_______________________________________________________________________。
(2)精制粗盐水所需试剂为①BaC12;②Na2CO3;③HC1;④NaOH,其滴加的先后顺序是下列的________(填下列各项的序号)。
a.①②④③ b.④②①③ c.④①③② d.②④①③
已知, ,假设该粗盐水中
,假设该粗盐水中 的浓度均为0.01 mol·L-1,若向1 L该粗盐水中逐渐滴入一定量Na2CO3溶液,首先出现的沉淀是__________。
的浓度均为0.01 mol·L-1,若向1 L该粗盐水中逐渐滴入一定量Na2CO3溶液,首先出现的沉淀是__________。
(3)已知SiCl4的沸点是57.6℃,CC14的沸点是76.8℃。在反应器I中得到的SiCl4粗品中含有CCl4,从中得到纯净SiCl4可采用的方法是下列各项中的________(填序号)。
a.蒸馏 b.干馏 c.分液 d.过滤
反应器Ⅱ中发生反应的化学方程式为__________________________________________。
(4)下图是用离子交换膜法电解饱和食盐水的示意图,电解槽中阴极产生的气体是_____。产品A的化学式为____________。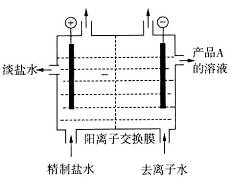
若采用无膜电解槽电解饱和食盐水可制取次氯酸钠,试写出该反应的化学方程式__ ___。
在苹果、香蕉等水果的果香中存在着乙酸正丁酯。某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯。实验步骤如下:
(一)乙酸正丁酯的制备
①在干燥的50mL圆底烧瓶中,加入13.5mL(0.15mol)正丁醇和7.2mL(0.125mol)冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石。
按下图所示安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口。
②打开冷凝水,圆底烧瓶在石棉网上用小火加热。在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中。反应达到终点后,停止加热,记录分出的水的体积。
(二)产品的精制
③将分水器分出的酯层和反应液一起倒入分液漏斗中,先用10 mL的水洗涤,
再继续用10 mL10%Na2CO3洗涤至中性,再用10 mL 的水洗涤,最后将
有机层转移至锥形瓶中,再用无水硫酸镁干燥。
④将干燥后的乙酸正丁酯滤入50 mL 烧瓶中,常压蒸馏,收集124~126℃的
馏分,得11.6g产品。
(1)写出该制备反应的化学方程式_______________。
(2)冷水应该从冷凝管___________(填a或b)管口通入。
(3)步骤②中不断从分水器下部分出生成的水的目的是__________________。步骤②中判断反应终点的依据是_______。
(4)产品的精制过程步骤③中,洗的目的是______________________。两次洗涤完成后将有机层从分液漏斗的__________置入锥形瓶中。
硫代硫酸钠(Na2S2O3)又名大苏打、海波,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室常以硫化钠(Na2S)为原料制取Na2S2O3。
实验项目I:工业级硫化钠的纯化。
本实验对Na2S的纯度要求较高,利用图1所示的装置将工业级的Na2S提纯。
已知:Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为:
① 将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
② 按图1所示连接仪器,水浴加热;冷凝管的作用是 。
向冷凝管中通入冷却水的方向是从 口进水(填“a”或“b”)。
③ 待烧瓶中固体不再减少时,停止加热,将烧瓶取下,趁热过滤,除去不溶物;
④ 将滤液转移至烧杯中,冷却结晶,过滤;
⑤ 将所得固体用少量 (填试剂名称)洗涤,干燥后得到Na2S·9H2O晶体。
实验项目II:硫代硫酸钠的制备。
制备步骤依次为:
① 称取一定质量的硫化钠晶体和碳酸钠固体,溶于水,转移至三颈瓶中;
② 按图2所示连接仪器,并在各仪器中加入相应的试剂,打开分液漏斗的活塞,使反应生成的气体较均匀地通入三颈瓶中,并用电磁搅拌器不断搅拌;仪器A的名称为 。
写出三颈瓶中发生的反应的化学方程式: 。
③ 随着气体的通入,逐渐有浅黄色的硫析出,继续通入气体至溶液pH接近7,停止通入气体,取下三颈烧瓶,过滤;实验过程中若未及时停止通入气体可能产生的后果为 。
④ 将滤液置于蒸发皿中加热,待 时,停止加热,冷却,过滤,即得Na2S2O3·5H2O晶体。
三氯化铁是合成草酸铁的重要原料。
(1)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:
①为抑制FeCl3水解,溶液X为 。
②上述流程中FeCl3能被异丙醚萃取,其原因是 ;检验萃取、分液后所得水层中是否含有Fe3+的方法是 。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是 。
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于如图所示仪器 (填“甲”或“乙”)中。下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是 。
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
(2)某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备单质铜和无水FeCl3,再由FeCl3合成Fe2(C2O4)3·5H2O。请补充完整由蚀刻废液制备单质铜和无水FeCl3的实验步骤(可选用的试剂:铁粉、盐酸、NaOH溶液和H2O2溶液):向废液中加入足量铁粉,充分反应后过滤;__________;___________;调节溶液pH,将溶液蒸发浓缩、冷却结晶、过滤、洗涤干燥得FeCl3·6H2O; ___________,得到无水FeCl3。
铜的硫化物可用于冶炼金属铜。为测定某试样中Cu2S、CuS的质量分数,进行如下实验:
步骤1:在0.7500g试样中加入100.00 mL 0.1200mol/mol KMnO4的酸性溶液,加热,硫元素全部转化为SO42-,铜元素全部转化为Cu2+,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250 mL容量瓶中,定容。取25.00 mL溶液,用0.1000mol/molFeSO4溶液滴定至终点,消耗16.00 mL。
步骤3:在步骤2滴定所得溶液中滴加氨水至出现沉淀,然后加入适量NH4HF2溶液(使Fe、Mn元素不参与后续反应),加入约1gKI固体(过量),轻摇使之溶解并发生反应:2Cu2++4I-=2CuI↓+I2。用0.05000mol/molNa2S2O3溶液滴定至终点(离子方程式为2S2O32-+I2 2I-+S4O62-),消耗14.00 mL。
2I-+S4O62-),消耗14.00 mL。
已知:酸性条件下,MnO4-的还原产物为Mn2+。
(1)若步骤3加入氨水产生沉淀时,溶液的pH=2.0,则溶液中c(Fe3+)=___________。
(已知室温下Ksp[Fe(OH)3]=2.6×10-39)
(2)步骤3若未除去Fe3+,则测得的Cu2+的物质的量将___________(填“偏高”“偏低”或“不变”)。
(3)计算试样中Cu2S和CuS的质量分数(写出计算过程)。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是_____________。
(2)在烧瓶中配制一定比例的乙醇和浓硫酸的混合液的方法是:__________________。
(3)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?______________,原因是____________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。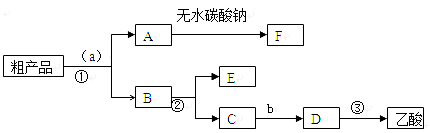
试剂a是__________,试剂b是__________;分离方法①是__________,分离方法②是__________,分离方法③是____________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是_________________。