三氯化铁是合成草酸铁的重要原料。
(1)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:

①为抑制FeCl3水解,溶液X为 。
②上述流程中FeCl3能被异丙醚萃取,其原因是 ;检验萃取、分液后所得水层中是否含有Fe3+的方法是 。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是 。
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于如图所示仪器 (填“甲”或“乙”)中。下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是 。

a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
(2)某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备单质铜和无水FeCl3,再由FeCl3合成Fe2(C2O4)3·5H2O。请补充完整由蚀刻废液制备单质铜和无水FeCl3的实验步骤(可选用的试剂:铁粉、盐酸、NaOH溶液和H2O2溶液):向废液中加入足量铁粉,充分反应后过滤;__________;___________;调节溶液pH,将溶液蒸发浓缩、冷却结晶、过滤、洗涤干燥得FeCl3·6H2O; ___________,得到无水FeCl3。
为了粗略测定电石中碳化钙的质量分数,某研究性学习小组设计了如下图所示的制气与除杂装置。请参与研究并回答相关问题: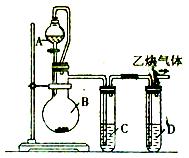
(1)写出烧瓶B中发生反应的 化学方程式:__________________________。
化学方程式:__________________________。
(2)漏斗与烧瓶之间用玻璃导管连接,其目的是_____________________________________。
(3)试管中装有同一种蓝色溶液,该溶液是____________,其中试管C的作用是_______________________,试管D的作用是____________ ____________。
____________。
(4) 为了测量产生的乙炔气体的体积,该小组同学设计了下图所示的两种装置。则应选择装置_______
为了测量产生的乙炔气体的体积,该小组同学设计了下图所示的两种装置。则应选择装置_______ __(填Ⅰ或Ⅱ)。
__(填Ⅰ或Ⅱ)。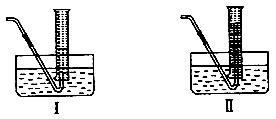
请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气。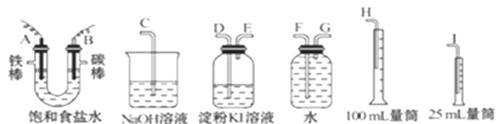
(1)A极发生的电极反应式是______ _______
_______ ______,
______,
B极发生的电极反应式是_______________________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:
A接______、 _____接______ ;B接_____ 、 _____接______ 。
(3)证明产物中有Cl2的实验现象是______。
(4)已知电解后测得产生的H2的体积为44.8 mL(已经折算成标准状况),电解后溶液的体积为50 mL,此时溶液中NaOH的物质的量浓度为:________。
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物物分子式的常用装置。

回答下列问题:
现准现准确称取0.44 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。请回答:按上述所 给的测量信息,回答问题:
给的测量信息,回答问题:
(1)A、B管内均盛有有固态试剂,A管的作用是______________________;
(2)E中应盛装什么试剂:_______________;
(3)如果把CuO网去掉,A管重量将____;(填“增大”、“减小”、或“不变”)
(4)请改进这套装置的一个不足之处:;
(5)该有 机物的实验式为__________________;
机物的实验式为__________________;
(6)要确定该有机物的分子式,还必须知道的数据是。
甲、乙两同学欲分别完成“钠与氯气反应”的实验。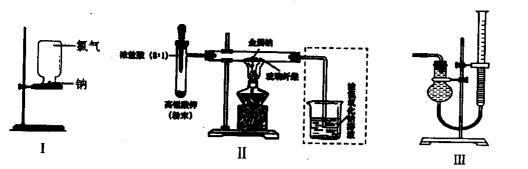
I.甲同学的方案为:取一块绿豆大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方(装置如图I)。该方案的不足之处有(至少答出两点)。
II.乙同学所采用的装置如图Ⅱ,回答下列问题:
(1)按图Ⅱ组装仪器、添加药品,实验开始后,先将浓盐酸挤入试管,试管中发生反应的离子方程式为;待装置中出现现象后,点燃酒精灯。
(2)点燃酒精灯后,玻璃管中出现的现象是。(至少答出三点)
(3)乙同学欲将虚框内装置改为图Ⅲ所示装置,并测量多余气体的体积。
①若图Ⅲ所示量气装置由干燥管、乳胶管和50mL滴定管组装而成,此处所用滴定管是(填“酸式”或“碱式”)滴定管。
②为提高测量的准确性,图Ⅲ装置中的液体可用;收集完气体并冷却至室温后读数,读数前应进行的操作是。
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积(填“偏大”、“偏小”或“无影响”)。
中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体。(图中部分产物和反应条件已略去)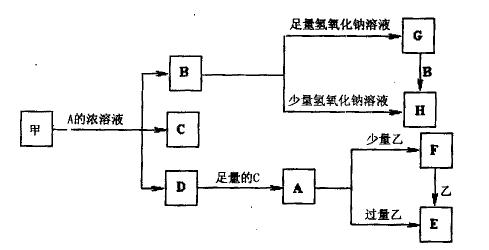
回答下列问题:
(1)写出甲与A的浓溶液反应的化学方程式。
(2)将等体积等浓度的G溶液和H溶液混合后得到的溶液中的离子浓度大小关系为。
(3)除去G固体中含有H杂质采用的方法是。
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝色的气体反应,生成一种盐,该盐的溶液呈酸性,其原因是(用离子方程式表示)。
(5)写出向E溶液中加入少量稀硫酸后反应的离子方程式
。
将溶液F加热蒸干、灼烧到质量不再减少时所得固体物质的化学式为。
(6)确定E中阳离子实验的方法为。