亚铁是血红蛋白重要组成成分,起着向人体组织传送O2的作用,如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种常见补药品说明书中的部分内容:该药品含Fe2+33%~36%,不溶于水但能溶于人体中的胃酸:与Vc(维生素C)同服可增加本品吸收。
(一)甲同学设计了以下下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:

(1)加入新制氯水后溶液中发生的离子反应方程式是_____________、Fe3+ +3SCN-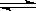 Fe(SCN)3 。
Fe(SCN)3 。
(2)加入KSCN溶液后溶液变为淡红色,说明溶液中有少量Fe3+。该离子存在的原因可能是____(填编号)。
A.药品中的铁本来就应该以三价铁的形式存在
B.在制药过程中生成少量三价铁
C.药品储存过程中有少量三价铁生成
(3)药品说明书中“与Vc同服可增加本品吸收”请说明理由_______________________。
(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为5Fe2++MnO4+8H+=5Fe3++ Mn2++4H2O。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
(4)该实验中的试剂2与甲同学设计的实验中的试剂1都可以是 (填序号)。
A.蒸馏水 B.稀盐酸 C.稀硫酸 D.稀硝酸
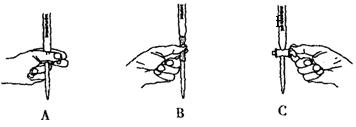
(5)本实验滴定过程中操作滴定管的图示正确的是_______(填编号)。
(6)请通过计算,说明该药品含“铁”量是否合格(写出主要计算过程)?
 3H2O+N2,而氮化镁遇水即反应生成Mg(OH)2和NH3,下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的空气已排除,图中箭头表示气体的流向)。
3H2O+N2,而氮化镁遇水即反应生成Mg(OH)2和NH3,下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的空气已排除,图中箭头表示气体的流向)。
(1)甲、乙两生提出的实验方案是否能制得氮化镁?(填“能”或“不能”)甲______乙_____。
(2)具体说明不能制得氮化镁的原因(如果两个方案都能制得氮化镁,此小题不用回答)。
答:________________________________________。
四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃;金属锡的熔点为231℃,拟用以下仪器,设计组装一套实验装置,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)请回答下列各个问题。
| A.用玻璃管(未画出)连接上述装置,正确的顺序是(填各接口的代字母) ( )接( )、( )接( )、( )接( )、( )接( )、( )接( ); |
| B.装置Ⅵ作用是______;装置Ⅳ的作用是______; |
| C.冷凝管里冷水的流向是从______进入,从________流出; |
| D.实验时应先点燃_______处酒精灯,加热温度应大于______℃,待_______即可停止加热; |
E.已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为_______。
F.如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是________。
G.为了防止污染空气,在装置的最后应_______。
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请完成下列问题:
(1)反应后所得的溶液漂白性增强的原因是____________________________________。
(2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有_________。
二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150 mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
请完成下列问题:
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是____________________________________________________。
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少A g,总共收集到标准状况下的CO2气体B L,发现 明显小于
明显小于 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________________________________________。
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________________________________________。
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是____________________________________。
某课外活动小组用如图所示装置制取次氯酸钠。图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸。
完成下列问题:
(1)烧瓶B中盛____________,大试管C中盛____________。
(2)C中发生反应的化学方程式________________________________________________。
(3)有同学认为可以省去某些装置,你认为怎样?
①能否省去乙装置_________(答“能”或“不能”),理由是_____________________________。
写出下列制取氯气的化学反应方程式:
(1)实验室用二氧化锰跟浓盐酸反应制取氯气的化学反应方程式为_____________________。
(2)高锰酸钾(KMnO4)是常用的氧化剂,在酸性条件下, 被还原成Mn2+。试写出用高锰酸钾跟浓盐酸在室温下制取氯气的化学反应方程式:____________________________。
被还原成Mn2+。试写出用高锰酸钾跟浓盐酸在室温下制取氯气的化学反应方程式:____________________________。
(3)历史上曾用“地康法”制取氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中氧气跟氯化氢反应制取氯气,化学反应方程式为__________________________。
从氯元素化合价的变化来看,以上三种方法的共同点是____________,比较以上三个反应,可得出三种氧化剂的氧化能力由强到弱的顺序为____________。