某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示。
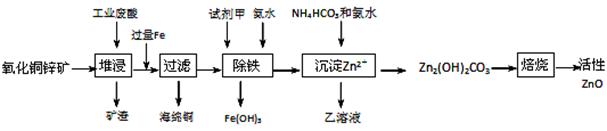
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO4 B.HNO3 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方程式 。
(5)298K时,残留在乙溶液中的c(Fe3+)在 __ mol/L以下。Fe(OH)3的KSP= 2.70×10-39
(6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式 。
I.下列实验方法:①分馏可把煤转化为焦炉气、煤焦油和焦炭等;②用升华法分离碘和砂子的混合物;③用重结晶法分离硝酸钾和氯化钠的混合物;④用分液法分离水和硝基苯的混合物;⑤用过滤法分离酒精和碘的混合物。你认为这些方法____________
| A.只有①②不正确 | B.只有⑤不正确 | C.只有②③④正确 | D.全部正确 |
II.如下图是制取溴苯的装置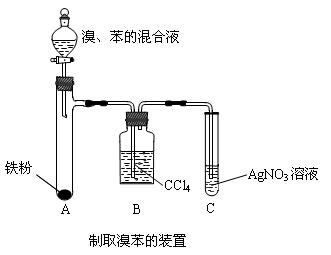
(1)装置A中发生反应的化学方程式__________________________________________,若装置C中的现象是____________________________________,则说明装置A中发生的反应类型是取代反应而不是加成反应。
(2)简述装置B中CCl4的作用:__________________________________________________。
(3)实验完毕后,常将A管中的液体倒在盛有氢氧化钠溶液的烧杯中振荡,静置片刻后,烧杯_______(填“上”或“下”)层为无色的溴苯,氢氧化钠溶液的作用是____________________________。
(1)下表为烯类化合物与溴发生加成反应的相对速率。(以乙烯为标准)
| 烯类化合物 |
相对速率 |
| (CH3)2C |
10.4 |
| CH2CH |
2.03 |
| CH2 |
1.00 |
| CH2 |
0.04 |
据表中数据,总结烯类化合物加溴时,反应速率与CC上取代基的种类、个数间
的关系:。
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率
最慢的是(填代号)
| A.(CH3)2C |
B.CH3CH |
| C.CH2 |
D.CH2 |
(3)已知:①下列框图中B的结构简式为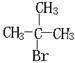 ;
; ;
; 其中部分反应条件、试剂被省略。
其中部分反应条件、试剂被省略。
 |
试回答下列问题:
(1)分别写出A 和D的结构简式 ,;
,;
(2)反应②的化学方程式为,反应类型为。
(3)写出C物质的一种同系物。
(4)写出A的另一种同分异构体的结构简式。
A是乙烯与水加成后的产物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。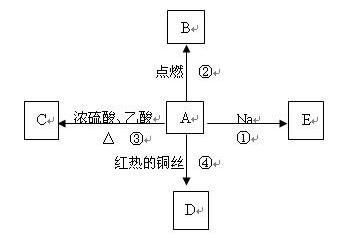
(1)A的结构简式为 ,它的官能团名称为。
(2)若A中的氧原子为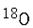
 ,则 A与乙酸的反应产物中含有
,则 A与乙酸的反应产物中含有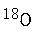 的物质是(填化学式)。
的物质是(填化学式)。
(3)写出下列反应的化学方程式
反应①
反应③ 
反应④
(1)①研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
| A.铁片置于硫酸铜溶液中有铜析出; |
| B.铁、铜与氯气反应分别生成FeCl3、CuCl2; |
| C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2) |
| D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡 |
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
②请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;
b.在方框内绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象并用相关化学用语解释现象
(2)学完原电池的相关知识后,甲组同学认为构成原电池必须有三个条件:①活动性不同的两极;②电解质溶液;③闭合回路。乙组同学对条件①提出异议,认为相同的两极也可以构成原电池,以下为乙组同学的实验装置简图以及实验报告的部分内容。请仔细阅读实验报告,然后将实验报告补充完整并填在相应的横线上。装置中盐桥的作用之一是使整个装置构成闭合回路。
浓差电池与温差电池
一、【实验目的】
1、电池中两杯溶液及电极均相同,两杯溶液的浓度不同,可否形成原电池
2、电池中两杯溶液 及电极均相同,两杯溶液的温度不同,可否形成原电池
及电极均相同,两杯溶液的温度不同,可否形成原电池
3、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
4、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
二、【仪器与药品】略。
三、【实验方法与步骤】
Ⅰ、实验方法:略。
Ⅱ、研究的步骤
㈠实验A:浓差电池
电解液均为硫酸铜,电极均为铜片:
1、甲烧杯中固定装入浓度 0.8 mol/L 的硫酸铜溶液。
2、乙烧杯中分別装入浓度 0.8 mol/L、0.4 mol/L 、0.2 mol/L、0.1 mol/L、0.05 mol/L、0.025 mol/L 的硫酸铜溶液。
3、使用铜片当电极。测量这六种组合电池的稳定电压及电流,将结果记录于表 1。
㈡实验B:温差电池
电解液均为硫酸铜,电极均为铜片:(步骤略,结果记录于表2)
四、【实验结果】
实验A:浓差电池:表1
| 甲杯硫酸铜浓度 mol/L |
0.8 |
0.8 |
0.8 |
0.8 |
0.8 |
0.8 |
| 乙杯硫酸铜浓度 mol/L |
0.8 |
0.4 |
0.2 |
0.1 |
0.05 |
0.025 |
| 两杯溶液浓度差值 |
0 |
0.4 |
0.6 |
0.7 |
0.75 |
0.775 |
| 电压 mV |
0 |
6 |
12 |
16 |
22 |
26 |
电流 mA mA |
0 |
0.02 |
0.04 |
0.06 |
0.07 |
0.08 |
实验B:温差电池:表2
| 甲杯硫酸铜温度℃ |
19 |
19 |
19 |
19 |
19 |
19 |
| 乙杯硫酸铜温度℃ |
19 |
29 |
39 |
49 |
59 |
69 |
| 两杯溶液温差℃ |
0 |
10 |
20 |
30 |
40 |
50 |
| 电压 mV |
0 |
6.1 |
12 |
20 |
27 |
34 |
| 电流 mA |
0 |
0.025 |
0.047 |
0.07 |
0.15 |
0.18 |
五、【讨论】
1、浓差电池:若硫酸铜浓差电池放电较长一段时间后,可观察到甲杯高浓度的溶液颜色逐渐变浅,而乙杯颜色变深,而电压也逐渐下降,同时可观察到甲杯中铜片表 面有铜析出。
面有铜析出。
这说明:甲杯中的电极反应式为
乙杯中的电极反应式为
电池放电一段较长时间后电压下降的原因:
2、温差电池(略)
六、【结论】
由上述【实验结果】可得结论:
实验A: [来源:学&科&网Z&X&X&K]
实验B:(略)
甲、乙两小组同学给你什么启示:
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右(写出最佳答案)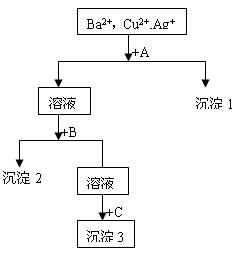
(1)沉淀的化学式:沉淀1,沉淀2,沉淀3;
(2)写出混合液+A的离子方程式
溶液+B的离子方程式