氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。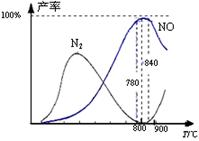
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
△H=-905 kJ·mol-1 ①
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
△H=-1268 kJ·mol-1 ②
下列说法中正确的是
| A.工业上氨催化氧化生成 NO时,温度应控制在 780~840℃之间 |
| B.工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率 |
| C.加压可提高NH3生成NO的转化率 |
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g) 2NO(g) △H=-181.5 kJ·mol-1 2NO(g) △H=-181.5 kJ·mol-1 |
氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是()
| A.若管道漏气遇氨就会产生白烟 |
| B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 |
| D.生成1 mol N2有6 mol电子转移 |
氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是()
| A.再通入少量氯气,c(H+)/c(ClO-)减小 |
| B.通入少量SO2,溶液漂白性增强 |
| C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-) |
| D.加入少量固体NaOH,溶液的pH会略微增大 |
有一瓶无色气体可能含有CO2、HBr、NO2、HCl、SO2中的一种或几种。将此气体通入足量稀氯水中,恰好完全反应,得无色透明溶液,把此溶液分成两份,分别加入盐酸酸化了的BaCl2溶液和硝酸酸化了的AgNO3溶液,均出现白色沉淀,以下结论正确的是()
| A.不能确定原气体中是否含有SO2 |
| B.原气体中肯定有HCl |
| C.原气体中肯定没有CO2 |
| D.原气体中肯定没有HBr、NO2 |
某同学用下列装置制备并检验Cl2的性质。下列说法正确的是()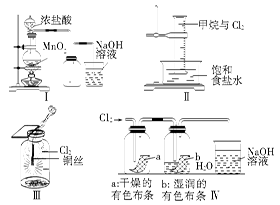
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗 |
| B.Ⅱ图中:量筒中发生了加成反应 |
| C.Ⅲ图中:生成蓝色的烟 |
| D.Ⅳ图中:湿润的有色布条能褪色 |
某兴趣小组设计如图装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是()
| A.钠在氯气中燃烧产生黄色的火焰 |
| B.反应产生的大量白烟是氯化钠固体 |
| C.棉球①的作用是吸收过量氯气防止产生污染 |
| D.棉球②变蓝色则证明氯气已被碱液完全吸收 |