某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( )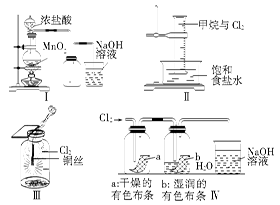
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗 |
| B.Ⅱ图中:量筒中发生了加成反应 |
| C.Ⅲ图中:生成蓝色的烟 |
| D.Ⅳ图中:湿润的有色布条能褪色 |
下列描述正确的是
| A.氯气、活性炭都能使品红溶液褪色,它们的漂白原理相同 |
| B.滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存 |
| C.某溶液中加入盐酸酸化的氯化钡产生白色沉淀,原溶液中一定含有SO42- |
| D.Fe(NO3)2溶液中滴加少量稀硫酸会变黄色 |
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体为
| A.2.24L | B.1.12L | C.0.672L | D.0.448L |
一定条件下可以大量共存的离子组是
| A.Na+、Fe2+、NO3-、Cl- | B.K+、HCO3-、SO42-、OH- |
| C.ClO-、Cl-、Na+、H+ | D.Ba2+、K+、SO42-、H+ |
某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
由此可知原溶液中
| A.原溶液中c(Fe3+)="0.2" mol·L-1 |
| B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1 |
| C.SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 |
| D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入足量酸性高锰酸钾溶液,若溶液紫红色褪去,则证明原溶液中有Fe2+ |
下列说法不正确的是
| A.在25℃时,将c mol·L-1的醋酸溶液与0.02mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10—9/(c—0.02) |
| B.0.1 mol·L-1醋酸溶液中:c(H+)2=c(H+)·c(CH3COO一)+KW |
| C.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO—)与pH值的关系如右图所示,当pH=4.5溶液中:c(CH3COOH)>c(CH3COO—)>c(H+)>c(OH—) |
| D.等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后 |