在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+ H2(g) CO(g)+ H2O(g) △H =" Q" kJ·mol—1
CO(g)+ H2O(g) △H =" Q" kJ·mol—1
其化学平衡常数K和温度t的关系如下:
| t℃ |
700 |
800 |
850 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答:
(1)上述反应中Q 0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是 。
(a) 容器中压强不变 (b) 反应热△H不变
(c) 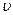 正(H2)=
正(H2)=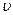 逆(CO) (d) CO2的质量分数不变
逆(CO) (d) CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
850℃时物质浓度(mol/L)的变化
| 时间(min ) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
C1 |
C2 |
C3 |
C3 |
| 4 |
C1 |
C2 |
C3 |
C3 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
|
①计算:3min时(CO的浓度)c1=_ _mol/L,H2O(g)的转化率= 。
②反应在4min—5min之间,平衡向逆方向移动,可能的原因是 (单选),
表中5min—6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
如图表示外界条件(温度、压力)的变化对下列反应的影响:L(s)+G(g) 2R(g)ΔH>0。在图中Y轴是指
2R(g)ΔH>0。在图中Y轴是指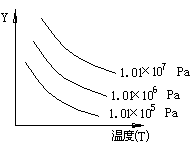
| A.平衡混合气中R的质量分数 | B.G的转化率 |
| C.平衡混合气中G的体积分数 | D.L的转化率 |
对可逆反应2A(s)+3B(g)  C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
| A.①② | B.③ | C.④ | D.④⑤ |
某温度下,密闭容器中发生反应aX(g)  bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
| A.可逆反应的化学计量数:a>b+c |
| B.压缩容器的容积时,v(正)增大,v(逆)减小 |
| C.达到新平衡时,物质X的转化率减小 |
| D.达到新平衡时,混合物中Z的质量分数增大 |
在给定的四种溶液中,加入以下各种离子后,各离子能在原溶液中大量共存的有
| A.滴加酚酞试液显红色的溶液:Fe2+、NH4+、Cl–、I– |
| B.水电离出来的c(H+)=10-13mol·L–1的溶液:K+、HCO3–、Br–、Ba2+ |
| C.在c(H+)=10-13 mol·L–1的溶液:K+、SO42–、Al3+、Cl– |
| D.PH=1的溶液:Cu2+、Na+、Mg2+、NO3– |
一定温度下反应N2+O2 2NO在密闭容器中进行,下列措施不改变化学反应速率的是
2NO在密闭容器中进行,下列措施不改变化学反应速率的是
| A.缩小体积使压强增大 | B.恒容,充入N2 |
| C.恒容,充入He | D.恒压,充入He |