下列说法中不正确的是 ( )
| A.在共价化合物中也可能含有离子键 |
| B.只由非金属元素组成的化学物可能含离子键 |
| C.含有共价键的化合物不一定是共价化合物 |
| D.含有离子键的化合物一定是离子化合物 |
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
| 物质 编号 |
物质转化关系 |
甲 |
乙 |
丙 |
丁 |
| ① |
 |
Cu] |
CuO |
CuCl2 |
Cu(NO3)2 |
| ② |
Na2CO3 |
NaOH |
NaHCO3 |
CO2 |
|
| ③ |
(NH4)2SO3 |
CaSO3 |
SO2 |
NH4HSO3 |
|
| ④ |
Al(OH)3 |
Al2O3 |
Na[Al(OH)4] |
AlCl3 |
| A.①②③④ | B.①②③ | C.①③④ | D.②④ |
T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为: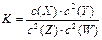 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
A.升高温度,平衡常数K增大 |
| B.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应 |
| C.增大压强,W(g)体积分数增加 |
| D.增大X(g)浓度,平衡向正反应方向移动 |
下列对有机物结构或性质的描述,错误的是
| A.一定条件下,Cl2与甲苯可发生取代反应 |
| B.苯酚钠溶液中通入CO2生成苯酚,则碳酸的酸性比苯酚弱 |
| C.乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O |
| D.光照下2,2—二甲基丙烷与Br2反应其一溴取代物只有一种 |
下列实验能达到预期目的的是
①用硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子;③用乙醇从碘水中萃取碘;
②用溴水检验汽油中是否含有不饱和链烃;④用盐析方法分离提纯蛋白质;
⑤用加热方法提纯含有少量碳酸氢钠的碳酸钠固体;
⑥用氨水清洗试管壁附着的银镜
| A.②④⑤ | B.①③⑥ | C.①②④⑤ | D.②③④⑤⑥ |
pH=l的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积的关系如图,下列说法正确的是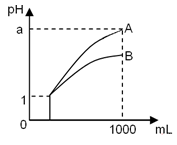
①若a<4,则A、B 都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A.①④ B.②③ C.①③ D.②④