右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 ( )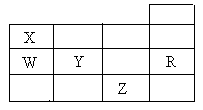
| A.常压下五种元素的单质中,Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的沸点比X的氢化物的沸点高 |
| D.Y元素的非金属性比W元素的非金属性强 |
对于可逆反应N2(g)+3H2(g) 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
| A |
B |
C |
D |
|
| 研究目的 |
压强对反应的 影响(P2>P1) |
温度对反应的影响 |
增加N2的浓度对反应的影响 |
催化剂对反应的 影响 |
| 图示 |
 |
 |
 |
 |
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是
| A.该装置为原电池,通入O2的电极是负极 |
| B.该装置中,通入SO2的电极的电极反应式为:SO2+O2-+H2O -2e- =2H++SO42- |
| C.该装置中,H+通过质子膜向左侧移动 |
| D.在标准状况下,理论上每消耗11.2L SO2,则可产生0.5mol H2SO4 |
高温下,某反应达到平衡,平衡常数K= 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应是焓变为正值 | B.该反应化学方程式为CO+H2O CO2+H2 CO2+H2 |
| C.升高温度,逆反应速率减小 | D.恒温下,缩小容器体积,H2浓度一定减小 |
一定条件下,下列不能用勒夏特列原理解释的是
| A.工业生产硫酸的过程中使用适当过量氧气,以提高SO2的转化率 |
| B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后气体颜色变深 |
| C.实验室用排饱和NaHCO3溶液的方法收集CO2气体 |
| D.新制氯水中,滴加硝酸银溶液,溶液颜色变浅,产生白色沉淀 |
下列各组实验装置能达到实验目的的是
| A.用图1所示装置组成锌铜原电池 |
| B.用图2所示装置在铁棒上镀锌 |
| C.用图3所示装置测定稀硫酸和稀NaOH反应的中和热 |
D.用图4所示装置研究温度对2NO2(g) N2O4(g)平衡的影响 N2O4(g)平衡的影响 |