下列对有关实验的说法正确的是( )
| A.向盛有碘水的分液漏斗中加入无水乙醇,振荡、静置,放出有机层后再蒸馏,提取碘水中的碘 |
| B.取淀粉、稀硫酸共热后的溶液与新制Cu(OH)2反应,无红色沉淀生成,说明淀粉未水解 |
| C.用浓盐酸酸化KMnO4溶液以增强其氧化性 |
| D.为除去粗盐中的Ca2+、Mg2+、SO42-,先后加入的试剂是H2O、Ba(OH)2、Na2CO3、HCl |
下列各组物质中,每种物质都是既有离子键又有共价键的一组是( )
| A.NaOH H2SO4 (NH4)2SO4 | B.MgO Na2SO4 HNO3 |
| C.Na2O2 KOH Na3PO4 | D.HCl Na2O MgCl2 |
下列分子中所有原子都满足最外层8电子结构的是()
| A.光气(COCl2) | B.六氟化硫 | C.二氟化氙 | D.三氟化硼 |
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( ) 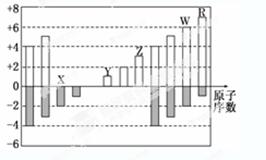
| A. | 原子半径:Z>Y>X |
| B. | 气态氢化物的稳定性:W>R |
| C. | WX 3和水反应形成的化合物是离子化合物 |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
运用元素周期律分析下面的推断,其中错误的是( )
| A.铍(Be)的氧化物的水化物可能具有两性 |
| B.砹(At)为有色固体;HAt不稳定;AgAt感光性很强,且不溶于水也不溶于稀酸 |
| C.硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
四种主族元素的离子a Xm+,bYn+,cZn-和dRm-(a,b,c,d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
①a-b=n-m②元素的原子序数a>b>c>d
③元素非金属性Z>R④最高价氧化物对应水化物碱性X>Y
| A.②③正确 | B.只有③正确 | C.①②③④正确 | D.①②③正确 |