某化学小组采用以下装置(如图一),以环己醇制备环己烯。已知:


图一[
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是  ,导管B除了导气外还具有的作用是
,导管B除了导气外还具有的作用是 
②试管C置于冰水浴中的目的是  。
。
(2)制备精品

图二
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按(图二)装置蒸馏,冷却水从 口进入(填字母)。蒸馏时要加入生石灰,目的是 。
|
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了 C.测定沸点
C.测定沸点已知X元素原子的K、L层的电子数之和比L、M层的电子数之和多1个电子。Y元
素的原子最外层电子数比内层电子数少3个。Z元素核外有3个电子层,最外层有3个电子。W元素最高化合价是最低化合价绝对值的3倍,它在最高价氧化物中的质量分数为40%。
(1)Y和W的气态氢化物的稳定性为(用化学式表示)>。
(2)X单质在空气中加热生成的化合物是化合物(填“离子”或“共价”)。
(3)X和Z的最高价氧化物对应水化物反应的离子方程式。
(4)W的低价氧化物与Y单质的水溶液反应的化学方程式。
(5)Y与Z形成化合物的化学式是。实验测得当此化合物处于固态和液态时不导电,溶于水能导电。由此判断该化合物具有键(填“离子”或“共价”)。
短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原
子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1∶1的原子个数比形成的化合物的电子式:。F的原子结构示意图为:。
(2)B、D形成的化合物BD2中存在的化学键为键(填“离子”或“共价”,下同)。A、C、F三种元素形成的化合物CA4F为化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为:。
(4)A、C、D、E的原子半径由大到小的顺序是(用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性于F(填“强”或“弱”),并用化学方程式证明上述结论。
已知X、Y是阳离子,Z是阴离子,M、N是分子,它们都由短周期元素组成,且具有
以下结构特征和性质:
①X、Y、M、N的核外电子总数相等;②常温下,M是极易溶于N的气体;③X与M均由相同的元素组成;④Y为单核离子,其与Z组成的物质可用于净水;⑤Z由同主族元素组成。请回答下列问题:
(1)X的电子式为,Z的离子符号为。
(2)X与Z形成的化合物中所含有的化学键类型为。
(3)写出Y与M、N形成的混合物发生反应的离子方程式:。
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列
问题: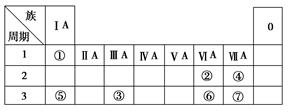
(1)④、⑤、⑦的原子半径由大到小的顺序为(用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为>。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式。
②写出检验A溶液中溶质的阴离子的方法:。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有。
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热
条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液洗后得到无色溶液F,溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。请回答下列问题:
(1)组成单质A的元素在周期表中的位置是。
(2)组成单质B的元素的原子结构示意图为。
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯,该反应的氧化剂为。
(4)溶液F在空气中长期放置生成H的化学方程式为。
(5)H的溶液与稀硫酸反应产生的现象为。