某学生设计了如下图所示的方法对A盐溶液进行鉴定:
由此分析,下列结论中不正确的是 ( )
| A.A中一定有Fe3+ | B.C中一定有Fe3+ |
| C.A可能为Fe2(SO4)3 | D.B一定为BaSO4 |
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如下图所示,则下列说法中正确的是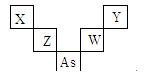
| A.Z的氧化物可与Y的氢化物水溶液发生化学反应 |
| B.X的原子半径比As原子半径小,两者原子序数之差为29 |
| C.W的氧化物对应的水化物是共价化合物,并且必是强酸 |
| D.图中五种元素均是非金属元素,并且Y的非金属性最强 |
用电解法制备无机高分子聚合物——聚合氯化铝。如图所示,在一定条件下进行,电解总反应可表示:Al+H2O+AlCl3 [Al2(OH)mClx-m]n+H2↑(未配平),则下面说法中正确的是
[Al2(OH)mClx-m]n+H2↑(未配平),则下面说法中正确的是
| A.Cu电极与电源正极相连 |
| B.聚合氯化铝化学式中x=4 |
| C.电解时阴极的电极反应式为:2H++2e¯=H2↑ |
| D.将电源换成导线连接两电极,则不能形成原电池 |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
测得纳米材料Fe3O4的微粒直径为90 nm |
纳米材料Fe3O4属于胶体 |
| B |
C(金刚石,s)===C(石墨,s) ΔH=-1.5 kJ·mol-1 |
通常石墨比金刚石稳定 |
| C |
Si有良好的半导体性能 |
Si可用于制备光导纤维 |
| D |
海水中含有大量的Cl-、Br-等离子 |
向海水中通入F2可大量获得Cl2、Br2 |
0.1mol·L¯1的Na2S溶液中,下面说法正确的是
| A.c(Na+) +c(H+)=c(OH-)+c(HS-)+c(S2-) |
| B.c(Na+) =2c(HS-) +2c(S2-) +c(H2S) |
| C.c(Na+)>c(OH-)>c(HS-)>c(H+) |
| D.c(H2S)+ c(HS-)+ c(H+)= c(OH-) |
水溶液中下列离子能大量共存的是
| A.K+、Fe3+、C6H5O-、HCO3- | B.H+、Cu2+、MnO4-、SO42- |
| C.Mg2+、Ag+、CO32-、NO3- | D.Na+、Al3+、BrO-、S2- |