某化学课外活动小组进行了一系列“带火星的木条复燃”的实验,实验装置如下图。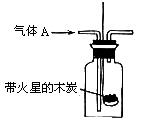
(1)甲组同学探究“使带火星木条复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下: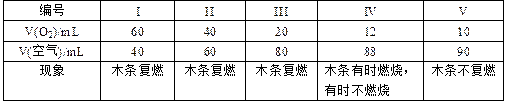
回答问题:
①使带火星木条复燃的O2的体积分数最小(第IV组数据)约为____________。
②用带火星木条检验集气瓶里是否集满O2,若木条复燃,能否认为集气瓶里的气体一定是纯净的O2?答:__________(填“能”或“否”)。
③若按照3:2的比例混合O2和CO2气体,该混合气体能否使带火星的木条复燃?答:___________(填“能”“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
| 编号 |
制取气体A(下列反应产生的混合气体) |
B中的现象 |
结论 |
| a |
在烧瓶中加热适量浓HNO3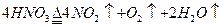 |
充满红棕色气体,木条不复燃,火星熄灭 |
NO2不支持燃烧 |
| b |
加热AgNO3固体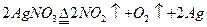 |
充满红棕色气体,木条复燃 |
NO2支持燃烧 |
| c |
加热Cu(NO3)2固体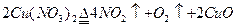 |
充满红棕色气体,木条复燃 |
NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?若不可靠,说明原因;若可靠,则不需说明。
a. ___________,原因是______________________________。
b. ___________,原因是______________________________。
c. ___________,原因是______________________________。
某学生为了探究钠与CO2的反应,利用如图装置进行实验.(已知PdCl2能被CO还原得到黑色的Pd)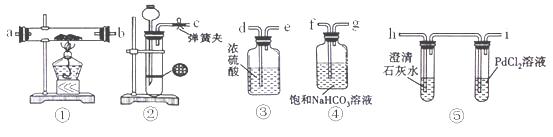
(1)请将上图各装置连接完整(填写装置中字母):c接f,接,接,接。
(2)若用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是。
| A.NaNO3溶液 | B.CCl4 | C.苯 | D.稀硝酸 |
(3)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到时再点燃酒精灯。
(4)反应过程中CO2足量,假如反应过程中有下列两种情况,分别写出两种情况下钠与CO2反应的化学方程式。
Ⅰ.装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体.。
Ⅱ.装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入到足量稀盐酸中产生224mL(标准状况)CO2气体,且溶液中还有固体残留.。
38.S2Cl2常用于橡胶硫化、有机物氯化的试剂,实验室可利用如下装置来制备S2Cl2。(部分夹持仪器已略去)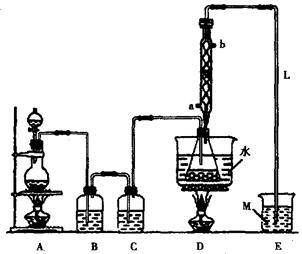
已知:①制备的反应方程式为: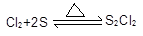
②反应涉及的几种物质性质如下:
| 性质 物质 |
熔点 |
沸点 |
着火点 |
其他性质 |
| 单斜硫 |
119.2℃ |
446.6℃ |
363℃ |
/ |
| 斜方硫 |
112.8℃ |
446.6℃ |
363℃ |
/ |
| S2Cl2 |
-77℃ |
137℃ |
/ |
遇水强烈分解生成S、SO2和HCl |
回答下列问题:
(1)A部分仪器装配时,放好铁架台之后,应先安放(填仪器名称)。整套装置装配完毕后,应先进行,再添加试剂,冷凝水进水口是(填“a”或“b”)。实验完毕,A中不再产生氯气时,可拆除装置,拆除时,最先进行的操作应是。
(2)S2Cl2分子中各原子均达到8电子稳定结构,写出其电子式;用化学方程式表示撤去C装置的后果;用直接加热代替水浴加热的后果是。
(3)单斜硫、斜方硫互称为,从熔点、沸点、着火点等信息得到的启示是。
(4)M溶液可以选择下列试剂中的(填序号)
①碳酸钠溶液 ②氯化铁溶液 ③亚硫酸钠溶液 ④高锰酸钾溶液
21.某中药主要含二硫化亚铁(FeS2),某学习小组欲用下图所示装置进行实验,测定其铁、硫元素的质量分数。
(1)装置中,A为高温灼烧装置,B为气体吸收装置,C为检测尾气中是否含有SO2的传感器。取m g该中药样品于装置A中,经充分反应,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,传感器(装置C)未检测到SO2。
① 装置B中的H2O2反应时表现出了性。
② 欲计算硫元素的质量分数,需测量的数据是。
③ 传感器的工作原理如下图所示。
传感器中阴极的电极反应式是。
(2)为测定铁元素的质量分数,继续实验。
a.将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生。充分反应后过滤,得到黄色滤液;
b.向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被氧化为TiO2+;
c.用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液。
① a中滤液含有的金属阳离子是。
② b中反应的离子方程式是。
③ c中K2Cr2O7被还原为Cr3+,样品中铁元素质量分数的数学表示式是。
20.某厂以重晶石(有效成分是BaSO4)为主要原料制取Ba(OH)2·8H2O晶体的示意图如下:
已知:i.BaSO4(s)+2C(s)=2CO2(g)+BaS(s)ΔH1=+226.2 kJ/mol
C(s)+CO2(g)=2CO(g)ΔH2=+172.5kJ/mol
ii.某些物质的溶解度(g/100g)简表
| 10℃ |
20℃ |
40℃ |
60℃ |
80℃ |
|
| Ba(OH)2·8H2O |
2.48 |
3.89 |
8.22 |
20.9 |
101 |
| NaOH |
98.0 |
109 |
129 |
174 |
314 |
| NaCl |
35.8 |
35.9 |
36.4 |
37.1 |
38.0 |
| BaCl2 |
33.5 |
35.8 |
40.8 |
46.2 |
52.5 |
回答下列问题:
(1)炭与重晶石直接反应的热化学方程式是:BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=____kJ/mol。
(2)由BaCl2溶液可通过不同途径得到Ba(OH)2·8H2O。
途径1:
①得到固体1的离子方程式是______。
②固体2与水反应的化学方程式是______。
途径2:
途径2中的“操作”是加热浓缩,冷却结晶,过滤。依据上述溶解度简表分析,过滤时的最佳温度是______;能从混合液中得到Ba(OH)2·8H2O晶体的原因是______。
(3)若向滤液1中加入CuO粉末,可直接得到含Ba(OH)2·8H2O晶体和CuS的浊液,反应化学方程式是______。将该浊液加热到80℃左右浓缩,趁热过滤,冷却滤液至室温,再过滤,即可得到Ba(OH)2·8H2O晶体。上述操作中趁热过滤的原因是______。
30.将11.2L(标准状况)乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了8.4g,求原气体混合物中乙烯与乙烷的物质的量之比和质量比。