下图为常温下向25mL 0.1 mol/L MOH溶液中逐滴滴加0.2 mol/LHA溶液过程中溶液pH的变化曲线。
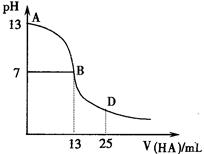
下列推断错误的是( )
A.M一定是碱金属元素
B.AB区间,c(OH-)>c(H+),则c(OH-)≥c(A-)
C. HA为弱酸
D. 在D点时,溶液中c(A-)+c(HA)=2c(M+)
能用电解原理说明的问题是( )
①电解是把电能转变成化学能
②电解是化学能转变成电能
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解的原理可以实现
⑤任何溶液被电解时,必然导致氧化还原反应的发生
| A.①②③④ | B.②③⑤ | C.③④ | D.①③④⑤ |
下列关于电解池的叙述中正确的是( )
| A.电解池中的闭合回路仅是由电子的定向移动形成的 |
| B.金属导线中,电子从电源的负极流向电解池的阳极,从电解池的阴极流向电源的正极 |
| C.在电解质溶液中,阴离子向阴极运动,阳离子向阳极运动 |
| D.相同时间内,阳离子在阴极上得到的电子与阴离子在阳极上失去的电子数相等 |
下图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,符合这一情况的是( )
| a电极 |
b电极 |
X电极 |
溶液 |
|
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池的说法中正确的是( )
| A.在熔融电解质中O2-由负极移向正极 |
B.电池的总反应是2C4H10+13O2 8CO2+10H2O 8CO2+10H2O |
C.通入空气的一极是正极,电极反应为:O2+4e-+2H2O 4OH- 4OH- |
D.通入丁烷的一极是正极,电极反应为:C4H10-26e-+13O2- 4CO2+5H2O 4CO2+5H2O |
据报道,摩托罗拉公司研制了一种有甲醇和氧气,以及强碱作电解质的手机电池,电量可达到镍氢电池的10倍,有关此电池的叙述错误的是( )
| A.溶液中的阳离子移向正极 |
B.负极反应式:CH3OH+8OH--6e- C+6H2O C+6H2O |
| C.电池在使用过程中,电解质溶液的c(OH-)不变 |
| D.当外电路通过6 mol电子时,理论上消耗1.5 mol O2 |