阅读下表中部分短周期主族元素的相关信息:
| 元素代号 |
相关信息 |
| T |
T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X |
X的原子最外层电子数是其内层电子数的三倍 |
| Y |
在第三周期元素中,Y的简单离子半径最小 |
| Z |
T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
请回答:
(1)元素T与X按原子个数比1:1形成的化合物B属于有 晶体。已知在通常条件下,39g B与足量CO2反应放出Q kJ的热量,写出该反应的热化学方程式 。
(2)将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),此过程中实验现象 。
(3)已知1mol化合物A与Na2SO3在溶液中发生反应时,转移 mol电子
(4)在一定条件下,X、Y两种单质以及有孔惰性电极在化合物TZ的水溶液中可形成原电池,为新型海水航标灯提供能源,写出该原电池正极的电极反应式 。
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。
I.用乙炔等合成烃C。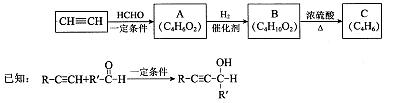
(1)A分子中的官能团名称是 、 。
(2)A的一种同分异构体属于乙酸酯,其结构简式是 。
(3)B转化为C的化学方程式是 ,其反应类型是 。
II.用烃C或苯合成PMLA的路线如下。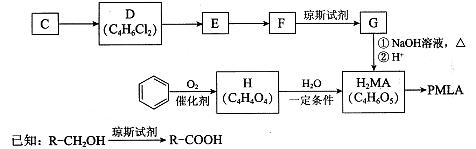
(4)1 mol有机物H与足量NaHC03溶液反应生成标准状况下的C02 44.8L,H有顺反异构,其反式结构简式是 。
(5)E的结构简式是 。
(6)G与NaOH溶液在加热条件下反应的化学方程式是 。
(7)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种) 。
化合物G的合成路线如下: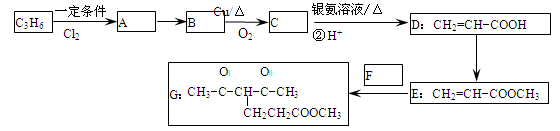
(1)D中含氧官能团的名称为 ,1 mol G发生加成反应最多消耗 mol H2
(2)除掉E中含有少量D的试剂和操作是 ;下列有关E的说法正确的是 (填字母序号)。
| A.可发生氧化反应 |
| B.催化条件下可发生缩聚反应 |
| C.可发生取代反应 |
| D.是CH2=CHCOOCH2CH3的同系物 |
E.易溶于水
(3)写出A→B的化学反应方程式 。
(4)反应E + F→ G属于下列麦克尔加成反应类型,则F的结构简式为 。
(5)比G少2个氢原子的物质具有下列性质:①遇FeCl3溶液显紫色;②苯环上的一氯取代物只有一种;③1mol物质最多可消耗2mol Na和1mol NaOH。任写一种该物质的结构简式 。
有机物A的分子式为C9H10O2,A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):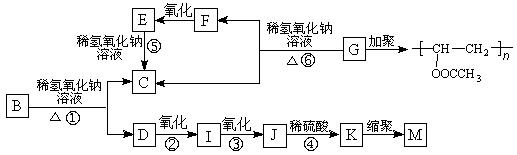
其中K物质与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构。
已知:①当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH→RCH2CHO;
②-ONa连在烃基上不会被氧化。
请回答下列问题:
(1)F与I中具有相同的官能团,该官能团的名称是 。
(2)上述变化中属于水解反应的是 (填反应编号)。
(3)写出结构简式,G: ,M: 。
(4)写出反应①的化学方程式: 。
(5)任写一种符合下列要求的A的同分异构体 。
I.含有苯环 II.能发生银镜反应,且能使氯化铁溶液显紫色
III.苯环上的一元取代物只有一种
已知A是生产某新型工程塑料的基础原料之一,合成A的路线如下图所示。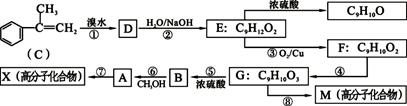
(1)与C分子式相同的一种物质化学名称叫:4-甲基苯乙烯,写出其结构简式_____。
(2)反应⑦为加聚反应,⑤的反应类型为______,写出A的结构简式为______,F的含氧官能团名称______。
(3)写出反应⑧的化学方程式______。
(4)A有多种同分异构体,符合下列条件的同分异构体有____种。
①分子中有6个碳原子在一条直线上②苯环上的一硝基取代物只有1种
③分子的核磁共振氢谱有4个吸收峰
写出其中一种与碳酸钠溶液反应的化学方程式:______。
芳香烃X是一种重要的有机化工原料,其摩尔质量为92g·mol一1,某课题小组以它为原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。已知A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
已知: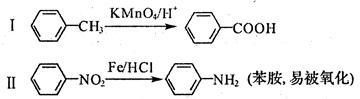
回答下列问题:
(1)对于阿司匹林,下列说法正确的是_______
| A.是乙酸的同系物 |
| B.能发生酯化反应 |
| C.1 mol阿司匹林最多能消耗2mol NaOH |
| D.不能发生加成反应 |
(2)H的结构简式是_________,F→G的反应类型是_______。
(3)写出C→D的化学方程式_______。
( 4)写出符合下列条件的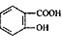 的同分异构体的结构简式_______。(写出2种)
的同分异构体的结构简式_______。(写出2种)
①属于芳香族化合物,且能发生银镜反应;
②核磁共振氢谱图中峰面积之比为1 :2:2:1
③分子中有2个羟基
(5)以A为原料可合成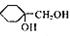 ,请设计合成路线,要求不超过4步(无机试剂任选)。
,请设计合成路线,要求不超过4步(无机试剂任选)。
注:合成路线的书写格式参照如下示例流程图: