工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即在沸腾炉中煅烧黄铁矿、SO2的催化氧化及其SO3的吸收。请回答下列几个有关硫酸工业中的几个问题。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O  Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )
Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )
| A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4 |
| B.b中产物用紫色石蕊试液即可检验出其中H+和SO42— |
| C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |
(2)从沸腾炉中出来的炉气必须经除尘、洗涤、干燥后进入接触室,其主要目的是__________。
(3)接触室中热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是______________。
(4)接触室中主要反应是SO2的催化氧化,在生成硫酸的过程中,钒触媒(V2O5)所以能加快二氧化硫氧化的速度,除了具有吸附作用外,有人认为反应过程中还产生了一连串的中间体(如图)。c步的化学方程式可表示为_______________________。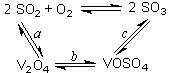
(5) 工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。将尾气通入粉末状的碳酸钙或熟石灰的悬浊液中,经过一系列处理后得到一种相对分子质量为172的化工原料J。试写出J的化学式_________。
某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验: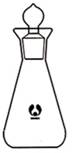
步骤Ⅰ:称取0.4g花生油样品,置于干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使花生油全部溶解。向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤Ⅱ:在暗处放置30min,并不时轻轻摇动。30min后,小心地打开玻
璃塞,用新配制的10%碘化钾10mL(足量)和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1mol·L-1Na2S2O3溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:


①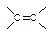 +IBr →
+IBr → ②IBr+KI=I2+KBr③I2+2S2O32-=2I-+S4O62-
②IBr+KI=I2+KBr③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应使用
(填仪器名称)。
用方程式表示碘瓶必须干燥的原因。
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是。
(3)步骤Ⅲ中所加指示剂为,滴定终点的现象。
(4)反应结束后从液体混合物中回收四氯化碳,则所需操作有。
(5)若步骤III中消耗Na2S2O3溶液为 V mL,要想把该花生油转化为硬化油,4g该花生油最多消耗标准状况下的氢气L。


用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象可得出两条有关过氧化钠跟水反应的结论是:第一:有氧气生成;
第二:____________________。
(2)某研究性学习小组拟用如下图所示的装置进行实验,以验证上述结论。用以验证第一条结论的实验操作_______________ ,现象是______________________。
为了验证第二条结论,将管口b浸入水中,可观察到的现象为_____________。
(28分)
[1]由碳、氢、氧三种元素组成的某有机物分子中共含有13个原子,其原子核外共有40个电子,l mol该有机物在氧气中完全燃烧时需消耗5.5 mol O2。请回答:
(1)试求出该有机物的分子式为 。
(2)若该有机物可使溴水褪色,且分子中不含有甲基,也不能发生银镜反应,取0.1 m ol该有机物与足量钠反应,能产生1.12 L H2(标准状况),则该有机物的结构简式可能是 ;该有机物在一定条件下发生聚合反应的化学方程式是 。
ol该有机物与足量钠反应,能产生1.12 L H2(标准状况),则该有机物的结构简式可能是 ;该有机物在一定条件下发生聚合反应的化学方程式是 。
(3)若该有机物能发生银镜反应,且分子中只含有一个甲基,则其结构简式是 。
(4)若该有机物的结构呈环状,且既不含甲基又不含羟基,则其键线式是 。
|
[2]2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为,它配以辅料丙二
|
醇

在75℃左右,实验室用HgSO4做催化剂,可使乙炔与水反应制取乙醛。装置图如下:(夹持装置均已略去)
供选用试剂:电石(混有CaS等杂质)、HgO粉末、浓H2SO4、NaOH溶液、蒸馏水
资料提示:CaS遇水会产生H2S气体;HgSO4遇到H2S会发生催化剂中毒而失去活性。
回答下列问题:
(1)加入药品前,必须对装置进行的操作是:。
(2)装置B中盛放的试剂为 ,作用是
(3)写出A中发生的主要反应的化学方程式
(4)反应温度应控制在75℃左右,采用E装置的优点是
有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图装置(夹持装置仪器已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。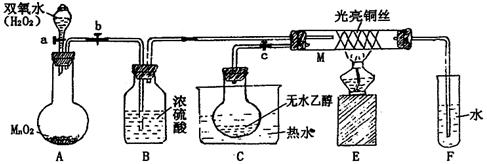
(1)A中发生反应的化学方程式:_______________________________ ,
B的作用:________________________;
(2)M处发生的反应的化学方程式为:______________________________________
(3)该实验过程中催化剂______________ (填“参加”或“不参加”)了化学反应
(4)实验乙醇氧化产物的试剂是,并写出对应的化学方程式
。
(5)若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含
有。要除去该物质,可现在混合液中加入(填写字母)。
| A.氯化钠溶液 | B.苯 | C.碳酸氢钠溶液 | D.四氯化碳 |