右图是5.56g绿矾(FeSO4·7H2O)隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液,得白色沉淀2.33g。下列说法中正确的有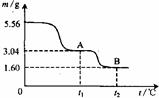
| A.可用酸性高锰酸钾溶液检验FeSO4溶液是否变质 |
| B.温度为t2时,固体B的化学式为FeO |
| C.在隔绝空气条件下A得到B的化学方程式为 FeSO4  FeO+SO3 FeO+SO3 |
| D.若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为FeO |
张清莲是我国著名的化学家。1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值。这是原子量表中的首次采用我国测定的原子量值。已知In的原子结构如图所示,则下列关于In的说法不正确的是
| A.In为长周期元素 |
| B.In为过渡元素 |
| C.In易导电导热 |
| D.In在反应中容易失电子 |
下列变化过程中表示的能量转化关系错误的是
| A.植物光合作用:光能→生物质能 |
| B.电灯发光:电能→化学能 |
| C.木柴煮饭:生物质能→热能 |
| D.太阳能热水器:光能→热能 |
23Na与23Na+比较,相同的是
| A.微粒半径 | B.化学性质 | C.最外层电子数 | D.中子数 |
已知某元素的原子序数,则不能推出该元素原子的
A. 质子数 质子数 |
B.中子数 | C.电子数 | D.核电荷数 |
在人类已知的化合物中,种类最多的是
A 过渡元素的化合物 B第ⅡA族元素的化合物
C 第ⅢA族元素的化合物 D第ⅣA族元素的化合物