利用如图所示装置进行实验,能实现实验目的是(必要时可加热)
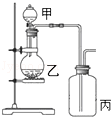
| 选项 |
实验目的 |
甲 |
乙 |
丙 |
| A |
制取并收集NH3 |
浓氨水 |
CaO |
H2O |
| B |
制取并验证碳酸酸性比硅酸强 |
浓盐酸 |
大理石 |
硅酸钠溶液 |
| C |
制取并验证Cl2没有漂白性 |
浓盐酸 |
MnO2 |
干燥的红布条 |
| D |
制取并验证SO2具有漂白性 |
70%硫酸 |
Na2SO3 |
品红试液 |
已知0.1 mol?L-1的醋酸溶液中存在电离平衡:CH3COOH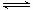 CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
| A.加少量烧碱溶液 | B.升高温度 |
| C.加少量冰醋酸 | D.加少量醋酸钠溶液 |
25℃时,下列说法正确的是
| A.将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时:2c(NH4+) = c(SO42-) |
| B.将稀氨水逐滴加入到稀硫酸中,当二者恰好完全反应时:c(OH-)+c(SO42-) = c(H+)+c(NH4+) |
| C.若等体积等浓度的HCN溶液与NaCN溶液混合后溶液显碱性:c(CN-)>c(HCN) |
| D.pH=3的盐酸和pH=11的氨水等体积混合后:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
下列事实不能用勒夏特列原理解释的是
| A.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B.钢铁在潮湿的空气中容易生锈 |
| C.工业合成氨时常用通过量氮气的方法提高氢气的转化率 |
| D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
下列说法正确的是
| A.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性判断的依据 |
| B.△H﹤0,△S﹥0的反应在低温时不能自发进行 |
| C.需加热才能发生的反应一定是△H﹥0 |
| D.CaCO3(s)受热分解为CaO(s)和CO2(g)反应的△S﹥0 |
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是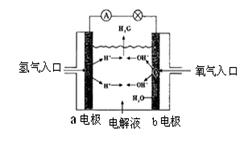
| A.a电极是负极 |
| B.b电极反应式为:4OH-—4e-= 2H2O+O2↑ |
| C.该电池是具有广泛发展前景的绿色电池 |
| D.该电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |