高铁酸钾是一种重要的水的处理剂,实验可用下列流程制取高铁酸钾,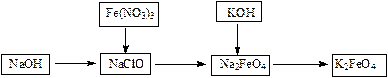
⑴NaClO溶液中加入NaOH固体形成碱性环境。
⑵将研磨的Fe(NO3)3少量多次的加入到上述溶液中,冰浴中反应1h。
采用少量多次加入,其目的是___________________________;该反应的离子方程为:
_____________________________________。
⑶将KOH加入到反应后的溶液搅拌半小时。静置,抽滤的粗产品。该反应的化学方程式为:_____________________________。
⑷依次用甲苯、乙醇、乙醚洗涤以除去水份和KNO3、KCl、KOH等杂质。
⑸在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色。现称取5.000 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00mL,再用稀硫酸酸化,用0.1000 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液33.33 mL。
①滴定时适宜选用的滴定管是: (a、酸式,b、碱式)。
②计算上述实验制得的样品中,高铁酸钾的质量分数为_________________。
③若上述过程中,测得的样品中高铁酸盐的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________ 。
对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则关于X、Y、Z、W四种物质的聚集状态说法正确的是()
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则关于X、Y、Z、W四种物质的聚集状态说法正确的是()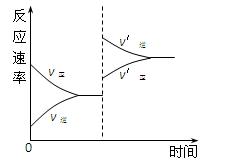
| A.X、Y均为气体,Z、W中有一种为气体 |
| B.Z、W中有一种是气体,X、Y皆非气体 |
| C.X、Y、Z、W皆非气体 |
| D.Z、W均为气体,X、Y中有一种是气体 |
由铝和某些金属氧化物组成的混合物在化学上称为铝热剂,该混合物在高温条件下能发生置换反应。为确定某铝热剂样品(铝和氧化铁)的组成,分别进行下列实验:
(1)若取10.7 g该样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为a L。反应的化学方程式是,样品中铝的质量分数是(用含a的表达式表示)。
(2)若取同质量的样品,在高温下使其恰好反应,则a =L;该反应的化学方程式是。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为b L,该气体与(1)中所得气体的体积比a∶b =_______。
已知A、B、C均为常见单质,其中A是金属,B、C是非金属,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。
请回答下列问题:
(1)若常温下,B、C均为气体,D为黑色磁性固体,则C的化学式为, A和E反应生成D的化学方程式为。
(2)若常温下,B为气体,C为黑色固体粉末,则金属A的原子结构示意图为, A和E在一定条件下反应生成D的化学方程式为。
“比较法”是化学研究的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如: 2Na2O2+2CO2=2Na2CO3+O2, Na2O2+CO=Na2CO3。
(1)试分别写出Na2O2与SO2、Na2O2与SO3(g)反应的化学方程式:
、
(2)当1 mol SO3(g)参加反应时,转移电子的物质的量为mol。
(3)通过比较可知:在氧化物中,当非金属元素处于(填“最低”、“中间”或“最高”)价时,其氧化物与过氧化钠反应就有O2生成。
A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是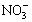 、S
、S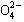 、Cl—、C
、Cl—、C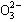 的某一种。
的某一种。
(1)若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
(2)若向(1)的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。
根据(1) 、(2)实验事实可推断它们的化学式为:
A.B.C.D.