甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题: 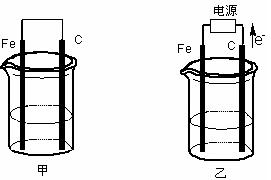
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的 棒;乙池中的 棒。
②在乙池中阳极的电极反应式是 。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中发生总反应的离子方程式 。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则溶液混匀后的pH= 。
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。从溶液中将Cu2+、Fe2+、Fe3+沉淀为氢氧化物所需pH分别为6.4,6.4,3.7。现有某氯化铜晶体中含有FeCl2杂质,为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图所示步骤进行提纯。
回答下列问题:
(1)最适合本实验的氧化剂是_____________。(填序号)
a.K2Cr2O7 b.H2O2 c.NaClO d.KMnO4
加入氧化剂对应的离子方程式为:_____________________________。
(2)物质Y是______________(填名称)。
(3)本实验加碱沉淀法能不能达到目的?______________原因是_________________________。
(4)最后能否直接蒸发结晶?若不能,应如何操作? _________________。
(5)加氧化剂的目的是__________________________。
(6)除去Fe3+的有关离子方程式_______________________________。
雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
据此判断:
①该反应的ΔH__________0(填“>”或“<”),ΔS__________0(填“>”或“<”)
②在T1温度下,0~2 s内的平均反应速率v(N2)=____________________。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若增大催化剂的表面积,则CO转化率__________(填“增大”,“减少”或“不变”)
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填字母)。

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)ΔH=-867.0 kJ·mol-1
2NO2(g) N2O4(g)ΔH=-56.9 kJ·mol-1
N2O4(g)ΔH=-56.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(g)的热化学方程式_________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极a、b表面发生的电极反应式分别为
a:_________________________________________;
b:_________________________________________。
【化学选修2—化学与技术】电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。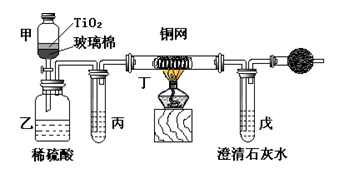
回答下列问题:
(1)乙中反应的离子方程式为 ,氧化产物是 ;
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是 (填字母),原因是 ;
a.饱和食盐水 b.饱和NaHCO3溶液 c.浓NaOH溶液 d.浓硫酸
(3)丁在实验中的作用是 ,原理是 ;
(4)干燥管中装有物质是 ,作用是 ;
(5)戊中盛有含Ca(OH)20.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 ,请说明该测得值与实际处理的百分率相比偏高还是偏低 ;
(6)请提出两个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂) , 。
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250 ℃ |
300 ℃ |
350 ℃ |
| K |
3.041 |
1.000 |
0.120 |
由表中数据判断ΔH________0 (填“>”、“=”或“<”),化学平衡常数表达式K= ;
(2)300 ℃时,在体积为2.0 L的密闭容器中通入2 mol CO和4 mol H2 ,经过20 s 达到平衡状态,
①计算20 s内CO的反应速率为 ,此时容器中甲醇的体积分数为 ;
②若向上述平衡体系中同时加入1mol CO,2mol H2 和1mol CH3OH气体,平衡移动情况是__________(填“向右”、“向左”或“不移动”),原因是 ;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH1=-1277.0 kJ/mol
②2CO(g)+O2(g) = 2CO2(g)ΔH2=-566.0kJ/mol
③H2O(g) = H2O(l)ΔH3=-44 kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: ;
(4)甲醇,氧气可制作燃料电池,写出以氢氧化钾为电解质甲醇燃料电池负极反应式 ;如图,电解KI溶液制碘,在粗试管中加入饱和的KI溶液,然后再加入苯,插入一根石墨电极和一根铁电极,使用该燃料电池做电源,铁电极与 极(填正或负)相连接,通电一段时间后,断开电源,振荡试管,上层溶液为 色,当有1.27g 碘单质生成时,需要 g CH3OH。
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式 ;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为 ,滴定终点观察到的现象为 ;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
| 实验编号 |
1 |
2 |
3 |
4 |
| V(Na2S2O3)(mL) |
28.32 |
25.31 |
25.30 |
25.32 |
计算电池铜帽中Cu的质量分数为 ,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除
尽,则所测定c (Cu2+)将会 (填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2] =2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)= mol/L;
(4)已知pH>11 时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
| 开始沉淀的pH |
沉淀完全的pH |
|
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Zn2+ |
5.9 |
8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
② ;③过滤;
④ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。