氨是一种重要的化工产品,对工业具有重要的意义。
(1)实验室收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
(2)氨气的电子式和结构式分别为: , 。
全球海水中溴的藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及到的反应有:①
(写出离子方程式);②Br2+3CO32—=BrO3—+ 5Br—+3CO2↑;③BrO3—+ 5Br—+6H+=3Br2+3H2O。其中反应②中氧化剂是;还原剂是。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,
然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫的离子反应方程式:_。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是。下列可以用于海水中溴的萃取试剂的。
①乙醇②四氯化碳③硝酸④裂化汽油
硫铁矿又称黄铁矿(主要成分FeS2,杂质不含硫元素),是地壳中分布最广的硫化物。因其浅黄的颜色和明亮的金属光泽,常被误认为是黄金,故又称“愚人金”。
工业上硫铁矿主要用于接触法制造硫酸,其反应原理为:
①FeS2与O2高温下反应生成SO2;
②SO2在催化剂作用下与O2反应生成SO3;
③SO3与H2O反应生成H2SO4.
(1)若1.00吨SO2与O2的混合气体中含SO20.40吨,在一定条件下发生反应②,有80%的SO2发生转化,则反应后混合气体中SO3的质量分数是_________。
(2)现用80吨硫铁矿制硫酸,最后生产出100吨98%的硫酸。若反应过程中硫元素的损失率为5%,则硫铁矿中FeS2的质量分数为__________________。
(3)在浓硫酸中继续溶解SO3后所形成的液体称发烟硫酸,其浓度通常以游离的SO3含量来表示,如20%的发烟硫酸即表示在硫酸中含有20%的SO3。现有1L含SO330%的发烟硫酸(密度为1.95g/cm3),要把它稀释成质量分数为95%的浓硫酸,需加水约多少?(写出计算过程)
(4)已知:850℃~900℃时,硫铁矿在氧气中煅烧,可能发生下列反应:
①3FeS2+8O2→Fe3O4+6SO2
②4FeS2+11O2→2Fe2O3+8SO2
为使FeS2煅烧完全生成Fe2O3,工业上使用过量氧气,当氧气过量20%时,求所得炉气中SO2的体积分数。(写出计算过程)
57.将480 g纯净的FeS2在氧气中完全反应,若所得固体中n(Fe)∶n(O)=4∶a,此时消耗氧气b mol,试写出b与a的关系式_______________________。
铁及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-→Fe3O4↓+S4O32-+2H2O
①上述离子方程式中x=________;
②每生成1 mol Fe3O4,反应转移的电子为________mol;
(2)某高效净水剂可由Fe(OH)SO4聚合得到。工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为 。
高炉炼铁过程中发生的主要反应为: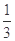 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g) 
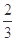 Fe(s)+CO2(g)+Q
Fe(s)+CO2(g)+Q
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ |
1000 |
1115 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
(3)该反应的平衡常数表达式K=_;Q0(填“>”、“<”或“=”);
(4)欲提高上述反应中CO的平衡转化率,可采取的措施是;
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(5)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,此时v正v逆(填“等于”、“大于”或“小于”)。经过l0 min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v (CO2)= 。
已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示: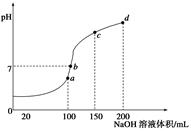
| I1 |
I2 |
I3 |
I4 |
|
| 电离能(kJ/mol) |
578 |
1817 |
2745 |
11578 |
(1)元素M的名称是_______________;
(2)硫原子核外有______种不同运动状态的电子,有______种不同形状的电子云;
(3)请用一个事实证明氧气的氧化性比硫的氧化性强:______________________________。
(4)相同条件下,0.1 mol/L NH4Al(SO4)2中c(NH4+)________(填“等于”、“大于”或“小于”)0.1 mol/LNH4HSO4中c(NH4+)。
(5)室温时,向100 mL 0.1 mol/LNH4HSO4溶液中滴加0.1 mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
①试分析图中a、b、c、d四个点,水的电离程度最大的是____________;
②在b点,溶液中各离子浓度由大到小的排列顺序是________;
③在c d段发生反应的离子方程式_________________。
由糠醛A制备镇痛药莫沙朵林的合成路线如下: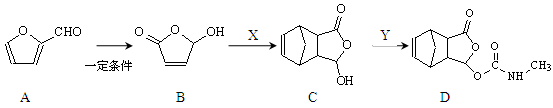
已知:最简单的Diels—Alder反应是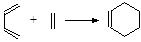
(1)糠醛与苯酚缩聚能生成高聚物糠醛树脂,写出反应化学方程式:______________。
(2)糠醛催化加氢后的产物为C5H10O2,与其互为同分异构体并属于羧酸,且烷基上一氯代物只有1种的有机物的系统命名为:_________________。
(3)已知B+X→C和C+Y→D都为加成反应,写出X与Y的结构简式:
X ____________________ Y _____________________ 。
(4)已知: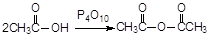 。请设计以
。请设计以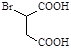 和
和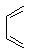 为原料合成化合物
为原料合成化合物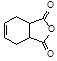 的实验方案。(用合成路线流程图表示为:A
的实验方案。(用合成路线流程图表示为:A B……
B…… 目标产物)。
目标产物)。