下列反应的离子方程式正确的是
A.硫化钠的水解反应:S2-+H3O+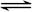 HS-+H2O HS-+H2O |
B.用铜做阳极电解氯化铜溶液:Cu2++2Cl- Cu+Cl2↑ Cu+Cl2↑ |
| C.在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O |
| D.在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7: |
Ba2++OH-+H++SO42-=BaSO4↓+H2O
某化合物的分子式为C5H11Cl,分析数据表明:分子中有两个—CH3、两个—CH2—、
一个 ,一个—Cl,它的可能的结构有()
,一个—Cl,它的可能的结构有()
| A.2种 | B.3种 | C.4种 | D.5种 |
可用于区别苯酚、乙醇、氢氧化钠、硝酸银、硫氰化钾五种溶液的一种试剂是()
| A.浓溴水 | B.石蕊试液 | C.FeCl3溶液 | D.FeCl2溶液 |
下列有关说法不正确的是
| A.具有相同通式的有机物不一定互为同系物 |
| B.分子组成相差一个或若干个CH2原子团的化合物一定互为同系物 |
| C.分子式为C3H8与C6H14的两种有机物一定互为同系物 |
| D.两个相邻同系物的相对分子质量数值一定相差14 |
仔细分析下列表格中烃的排列规律,判断排列在第12位的烃的分子式是()
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
…… |
| C2H2 |
C2H4 |
C2H6 |
C3H4 |
C3H6 |
C3H8 |
C4H6 |
C4H8 |
C4H10 |
…… |
| A.C6H12 | B.C6H14 | C.C5H12 | D.C5H10 |
下列有机物命名正确的是()
| A.2,3,3—三甲基己烷 | B.1,2,3—三甲基丁烷 |
| C.2-乙基丁烷 | D.3,3—二甲基丁烷 |