500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2 2NH3 △H<0。反应过程中H2、N2和NH3物质的量变化如右图所示,据图判断下列叙述不正确的是
2NH3 △H<0。反应过程中H2、N2和NH3物质的量变化如右图所示,据图判断下列叙述不正确的是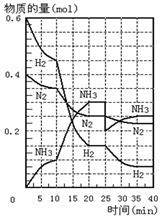
| A.反应开始到第一次平衡时,N2的平均反应速率为0.0625mol·(L·min)-1,H2的转化率为75% |
| B.反应达到第一次平衡时,反应的平衡常数表达式可写作:K=c2(NH3)/[ c3(H2) ·c(N2)]=(0.15 mol·L-1) 2/[(0.075 mol·L-1) 3 ·(0.125 mol·L-1)] |
| C.从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂 |
| D.从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动 |
下列判断错误的是
| A.沸点:NH 3>PH3>AsH3 | B.熔点:Si3N4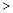 NaCl NaCl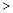 SiI4 SiI4 |
| C.酸性:HClO4>H2SO4>H3PO4 | D.碱性:NaOH>Mg(OH)2>Al(OH)3 |
下列叙述正确的是
| A.离子晶体中,只存在离子键,不可能存在其它化学键 |
| B.在卤族元素(F、Cl、Br、I)的氢化物中,HF的沸点最低 |
| C.NaHSO4、Na2O2晶体中的阴、阳离子个数比均为1 : 2 |
| D.晶体熔点:金刚石>食盐>冰>干冰 |
.在下列有关晶体的叙述中错误的是
| A.离子晶体中,一定存在离子键 | B.原子晶体中,只存在共价键 |
| C.金属晶体的熔、沸点均很高 | D.分子晶体中不一定含化学键 |
下列各组气体或溶液用括号内试剂加以鉴别,其中不合理的是
| A.二氧化碳、二氧化硫、一氧化碳(品红溶液) |
B.氯化钠、硝酸 银、碳酸钠(稀盐酸) 银、碳酸钠(稀盐酸) |
| C.酒精、醋酸、醋酸钠(石蕊试液) |
| D.硫酸、硝酸钡、氯化钾(碳酸钠溶液) |
若1.8g某金属跟足量盐酸充分反应,放出2.24L(标准状况)氢气,则该金属是
| A.Mg | B.Al | C.Fe | D.Zn |