刚切开的苹果,不久果肉的颜色就会变成褐色,即苹果的“褐变”。对此现象,有以下两种说法。
第一种说法:有人认为,其原因是果肉里的酚在空气中转变为二醌,这些二醌很快聚合成为咖啡色的聚合物。如图所示: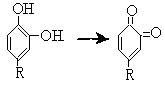
第二中说法:有人认为,其原因是果肉里的二价铁离子在空气中转变成三价铁离子。
针对这两种说法,请回答下列各小题:
(1)请设计简单实验来确认到底哪种说法正确(第一种说法只要证明出苹果果肉中含有酚类物质即可) 。
(2)若第一种说法正确,则图中变化的反应类型 (填序号)。
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(3)若苯环外的取代基与苯环直接相连的碳原子上有氢原子,不论取代基多长,在一定条件下都被氧化成羧基。若上述酚类物质R基为-CH=CHCH3,请设计途径完成转化: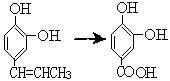 (只说出方案即可) 。
(只说出方案即可) 。
(4)写出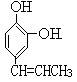 的含有一个取代基的属于酯类物质,且该酯类物质水解后得到苯酚的结构简式 。
的含有一个取代基的属于酯类物质,且该酯类物质水解后得到苯酚的结构简式 。
(5)若要避免苹果“褐变”,请你说出一种保存切开的苹果的方法, 。
实验室里需要纯净的氯化钠溶液,但现有的氯化钠晶体中混有少量硫酸钠和碳酸氢铵,设计一组实验去杂质。试简单回答下列问题。
(1)除去碳酸氢铵,用加热方法好,还是加入强碱微热的方法好?
答:______________,原因是____________________,判断碳酸氢铵已完全除去的方法是__________________________。
(2)加热的固体残渣溶于水后,应该用氯化钡溶液还是硝酸钡溶液除去SO42-?
答:_____________,原因是______________,判断SO42-已完全除去的方法是_________。
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分: 

请回答以下问题:
(1)混合粉末A中硫粉过量的原因是;
(2)反应在“惰气环境”中进行的原因是;
(3)操作①是用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明__________;
(4)操作②的作用是__________。反应方程式是。也可改用加入__________
(5)操作③稀H2SO4煮沸的目的是;
(6)为证明产物中铁的价态,对D溶液的实验操作最好是。
(1)欲证明铁、铜、银三种金属的活动性顺序,应该选用的试剂是,化学方程式是。
(2)将碎蛋壳放到盛有食醋(含CH3COOH)的家用杯子中,会产生一种能使澄清石灰水变浑浊的无色气体,可推知蛋壳的化学成分中含有。完成上述两个离子方程式:。如果给你少量澄清石灰水,你在家里如何操作可验证上述实验中产生的气体?简述操作过程:
。
实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体,流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请完成下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入_______,目的是_____________。
(2)反应中加入过量的乙醇,目的是_____________________________________________。
(3)如果将上述实验步骤改为蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加醋酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是____________________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
试剂a是_________________,试剂b是__________________,分离方法①是_______________,分离方法②是__________________,分离方法③是__________________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是_____________________________。
可用下图所示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。
请填空:
(1)试管a中需要加入浓硫酸,冰醋酸和乙醇各2 mL,正确的加入顺序及操作是
______________________________________________________________________________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是_________________。
(3)实验中加热试管a的目的是:
①____________________________________________________________________________;
②____________________________________________________________________________。
(4)试管b中加有饱和Na2CO3溶液,其作用是___________________________________。
(5)反应结束后,振荡试管b,静置。观察到的现象是______________________________。