饱和亚硫酸溶液的pKa(电离平衡常数的负对数,即pKa=-lgKa)数据如下:
(1)比较H2SO3的Ka1和HSO3-的Ka2,Ka1 Ka2(填‘‘>”、“<’’或“=”,下同)
(2)0.01 m ol.L-1NaHSO3溶液的pH=bl,0.01 tml·L-1NaHCO3溶液的pH=b2,
b1 b2
(3)向10 mL 0.01 mol·L-1的H2SO3溶液中,滴加0.0l mol·L-1KOH溶液V(mL),
①当V="10" mL时,溶液中存在:c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+) c(OH-)
②当V="a" mL时,溶液中离子浓度有如下关系:c(K+)=2c(SO32-)+c(HSO3-);当V="b" mL时,溶液中离子浓度有如下关系:c(K+)=c(SO32-)+c(HSO3--)+c(H2SO3);则a b。
(4)已知25℃时,Ksp(BaSO4)=1×10-10,将0.1 gBaSO4沉淀,分别用100mL蒸馏水和100mL 0.01mo1.L-1H2SO4溶液洗涤,两种洗涤方法中BaSO4沉淀的损耗量之比为 .
下列物质中,属于强电解质的是(),属于弱电解质的是(),属于非电解质的是()。
A碘化钾;B乙醇;C氨气;D蔗糖;E氢硫酸;F硫酸氢钠;G氨水;H液氧;I氢氧化钠溶液
健康人血液中的pH保持在一定范围内变化,这是因为血液中存在如下平衡:H2CO3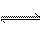
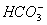 +H+,医学上称为血液酸碱平衡,试解答下列问题:
+H+,医学上称为血液酸碱平衡,试解答下列问题:
(1)蚊虫、蚂蚁等昆虫叮咬人时常向人体血液内注入一种称之为蚁酸(主要成分为HCOOH)的有机酸,HCOOH同CH3COOH一样是一种有机弱酸,写出HCOOH在溶液中电离的方程式:___________________________________。
(2)当人受到蚂蚁叮咬时皮肤上常起小疱,这是因为人体血液中酸碱平衡被破坏所致,若不看医生治疗,过一段时间小疱也会自行痊愈,这是由于血液中又恢复了原先的酸碱平衡,试用平衡移动原理解释上述事实:_____________________________________________________。
有A、B、C三种电解质溶液分别装在三个烧杯中,插有石墨电极,并按图所示方式在电路中连接。闭合开关K后,测得各支路电流强度ⅠⅠ≈ⅠⅡ(其中ⅠⅡ略小)。 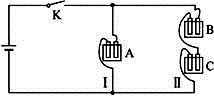
若撤去B,测知电流强度ⅠA<<ⅠC;若撤去C,并将A、B两溶液混匀后均分为两等份,再重置于电路Ⅰ、Ⅱ处,测知通过A、B混合溶液的电流强度与先前通过A溶液的电流强度的相对大小关系为:ⅠsAB>>ⅠA
已知A、B、C分别选自下列溶液:
①0.1 mol·L-1盐酸 ②0.1 mol·L-1醋酸 ③0.1 mol·L-1NaCl溶液 ④0.1 mol·L-1硫酸 ⑤0.1 mol·L-1 NaOH溶液 ⑥0.1 mol·L-1氨水,且25 ℃时,A溶液pH<7
回答下列问题:
(1)指出A、B、C是(或可能是)什么溶液?
A____________;B____________;C____________。
(2)若向C溶液中滴入酚酞试剂呈红色,则C是____________。将A、B、C分别以等体积进行两两混合,结果是哪种组合的混合液中,水的电离程度最大? ____________。(选填“A”“B”“C”)
Al(OH)3的电离方程式可表示为:H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
(1)向Al(OH)3沉淀中加入盐酸,沉淀溶解,其原因是________________________,有关的离子方程式为________________________。
(2)向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是________________________,有关的离子方程式为________________________。