合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨,制得的氨通过催化氧化可生产硝酸。
在一定条件下,若N2和H2以体积比1:3的比例充入一体积不变的密闭容器中反应,达到平衡状态时,测得混合气体中氨的体积分数为20.0%,则:
(1)合成氨反应达到平衡的标志 ▲ 。
| A.容器内气体压强保持不变 |
| B.容器内各物质的浓度不随时间变化 |
| C.当υ(H2,正)=0.3mol·L-1·min-1,υ(NH3,逆)=0.2mol·L-1·min-1时 |
| D.1个N≡N键断裂的同时,有3个H-H键形成 |
(2)达到平衡时,N2和H2的转化率分别为 ▲ 。
(3)用氨催化氧化可生产硝酸,取所生产的硝酸溶液100mL,与足量的铜反应,生成的NO2和NO混合气体在标准状况下体积为6.72L,物质的量之比为2:1,求所生产硝酸的物质的量浓度?(请写出该小题的计算过程)
▲ 。
(4)某厂用NH3生产硝酸,然后再制硝酸铵,其过程如下: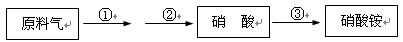
其中反应②为:4NO+3O2+2H2O 4HNO3,原料气为氨气和空气的混合物。
4HNO3,原料气为氨气和空气的混合物。
若实际生产中,反应①、②、③的转化率(或利用率)分别为a、b、c,则生产硝酸的氨气占所用氨气总量的体积分数为 ▲ 。
(6分)(1)硫化钠水溶液显碱性的原因_______________(用离子方程式表示)
(2)用硫化亚铁作沉淀剂除去污水中的Cu2+_______________________
(3)浑浊的石灰水中存在的溶解平衡________________
(10分)现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。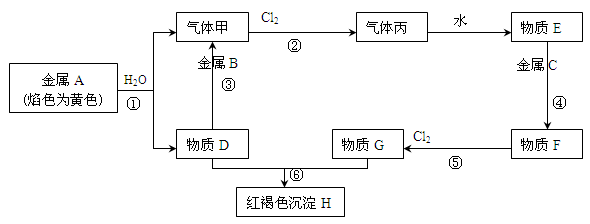
请回答下列问题:
(1)写出下列物质的化学式:B、丙
(2)写出下列反应的化学方程式:
反应①;
反应③;
反应⑥。
某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。请回答下列问题: 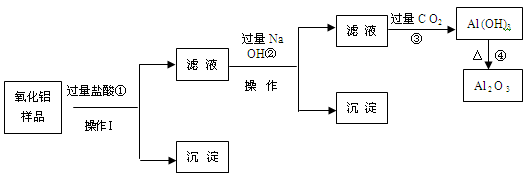
(1)沉淀A的成分是(填化学式),沉淀B的成分是(填化学式);
(2)滤液A中若加入过量的铁粉,可能发生的所有离子方程式为:
、 ;
(3)在操作Ⅰ的名称是,其中玻璃棒的作用是。
(共6分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)  Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
(1)该反应的氧化剂是,2molN2参加反应转移电子数为。
(2)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。
图中t4时引起平衡移动的条件可能是;图中表示平衡混合物中CO的含量最高的一段时间是。
(3)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是
(提示:272 = 729)
(共8分)过氧化氢水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度, 请填写下列空白:
(1)将10.00 mL过氧化氢溶液移至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数和化学式分别填在下列横线和括号内。
MnO4- +H2O2+H+="=" Mn2++H2O+( )
(3)移取10mL过氧化氢溶液可以用_______(填“酸式”或“碱式”)滴定管。滴定到达终点的现象是____。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的浓度为________。
(5)若盛装高锰酸钾标准溶液的滴定管用蒸馏水洗后没有用标准液润洗,则测定结果______(填“偏高”或“偏低”或“不变”)。