H2O2是在医疗、化工方面应用广泛的化学试剂。
(1)Na2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,则应选择的过氧化物是________;
(2)实验室可用H2O2与次氯酸钠反应制氧气, 其中还原剂是__________,写出反应的化学方程式______________,生成0.5mol氧气,转移电子_______mol;
(3)用酸性高锰酸钾溶液滴定法可测定双氧水中H2O2的含量,有两位同学分别用以下化学方程式表示其中的反应原理:
①5H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+5O2↑+8H2O
②3H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+4O2↑+6H2O
你认为其中错误的是_______(认为没有可以不填),简述理由__________________。
某芳香烃衍生物的分子式为C7H8O,根据下列实验现象,确定结构简式。
(1)若该有机物遇FeCl3溶液显色,则其可能的结构简式为:
,,。
上述的三种物质中,苯环上的一氯代物种类最少的一氯代烃有种,最多的一氯代烃有种。
(2)若该有机物不能与金属钠反应产生氢气,则结构中会有(填官能团)出现。
(3)若该有机物遇FeCl3溶液不显色,但与金属钠反应放出H2,则其反应的化学方程式为
。
(1)①键线式 表示的分子式;名称是。
表示的分子式;名称是。
②试写出 的键线式的表达式。
的键线式的表达式。
(2) 中含有的官能团的名称分别为。
中含有的官能团的名称分别为。
(3)请指出下列各立体图形所表达的具体意思:(如:是“某”物质的“某某”模型、是“某某”轨道等)
① ②
② ③
③
①(①②图中只有C、H、O三种原子)
②
③
如下图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g,试回答:
(1)电源电极X的名称为________。
(2)pH变化:A________,B________,C________。(填“增大”“减小”或“不变”)
(3)通电5 min后,B中共收集224 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200 mL,电解后,溶液中OH-的物质的量浓度为________(设电解前后溶液体积无变化)。
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用________(填字母)。
| A.铜 | B.钠 |
| C.锌 | D.石墨 |
(2)图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________极。
(10分)电解原理和原电池原理是电化学的两个重要内容。某兴趣小组做如下探究实验:
Ⅰ.(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)_______________________________设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________________________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因____________________________________________。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨(1)为________极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为_________________________________。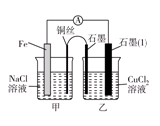
Ⅱ.如右图所示装置,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL。
请完成下列问题:
①第②极上生成的物质为________mol。
②写出第①极上发生反应的电极反应式_________________________。
③设A池中原混合液的体积为200 mL,则通电前A池原混合液中Cu2+的浓度为________ mol/L。