某班学生在老师指导下探究氮的化合物的某些性质。
(1)同学甲在实验室利用下列装置制取氨气和氧气的混合气体,并完成氨的催化氧化。
A中加入浓氨水,D中加入碱石灰,E内放置催化剂(铂石棉),请回答:
①仪器B的名称:_____________。B内只需加入一种固体试剂,该试剂的名称为__________,B中能产生氨气和氧气混合气体的原因(结合化学方程式回答)_ __。
②按气流方向连接各仪器 (填接口字母)
(2)同学乙拟用甲同学得到的混合气体X(NO及过量的NH3),验证NO能被氨气还原并测算其转化率(忽略装置内空气的影响)。装置如下: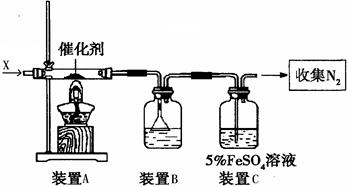
①装置C的作用可能是 ____________
②若进入装置A的NO共268.8mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下190.4 mL N2,则NO的转化率为
(3)N2O3是一种新型硝化剂。一定温度下,在恒容密闭容器中N2O3可发生下列反应:2N2O3+O2 4NO2(g);△H>0,下表为反应在某温度下的部分实验数据
4NO2(g);△H>0,下表为反应在某温度下的部分实验数据
| t/s |
0 |
500 |
1000 |
| c(N2O3)/mol·L-1 |
5.00 |
3.52 |
2.48 |
计算在t=500s时,NO2的反应速率为
在一个恒温恒容的密闭容器中,发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g),开始时充入容器中的起始物质是:①0.1 mol CO,0.1 mol H2②0.1 mol CO,0.2 mol H2O③0.1 mol CO,0.1 mol H2O④0.1 mol CO,0.1 mol H2O,0.1 mol H2。达到平衡时容器中H2的物质的量由小到大的排列顺序是____________。
在一密闭容器中充入1 mol NO2,建立如下平衡:2NO2 N2O4。平衡时测得NO2的转化率为a%。其他条件不变,再充入1 mol NO2,待新平衡建立时,测得NO2的转化率为b%。则a和b的大小关系为________________。
N2O4。平衡时测得NO2的转化率为a%。其他条件不变,再充入1 mol NO2,待新平衡建立时,测得NO2的转化率为b%。则a和b的大小关系为________________。
下列各组反应哪几组是可逆反应?为什么?
(1)2H2+O2 2H2O与2H2O
2H2O与2H2O 2H2↑+O2↑
2H2↑+O2↑
(2)NH3+H2O====NH3·H2O与NH3·H2O==== +OH-
+OH-
(3)CaCO3(s)====CaCO3(aq)与CaCO3(aq)====CaCO3(s)
(4) +OH-====NH3·H2O与NH3·H2O====
+OH-====NH3·H2O与NH3·H2O==== +OH-
+OH-
(5)2NH3 3H2+N2与N2+3H2
3H2+N2与N2+3H2 2NH3
2NH3
(6)SO2+H2O====H2SO3与H2SO3====SO2+H2O
(7)2SO2+O2 2SO3与2SO3
2SO3与2SO3 2SO2+O2
2SO2+O2
(8)2HI H2↑+I2↑与H2+I2
H2↑+I2↑与H2+I2 2HI
2HI
已知T K和P kPa时,在容积为V L的密闭容器中充有1 mol A和1 mol B,保持恒温恒压,使反应: A(g)+B(g) C(g)达到平衡时, C的体积分数为40%。试完成下列有关问题:
C(g)达到平衡时, C的体积分数为40%。试完成下列有关问题:
(1)若使温度和压强在上述条件下恒定不变,在密闭容器中充入2 mol A和2 mol B,则反应达到平衡时,容器的体积为________,C的体积分数为________。
(2)若另选一容积固定不变的密闭容器,仍然控制温度为T K,使1 mol A和1 mol B反应达到平衡状态时, C的体积分数仍然为40%,则该密闭容器的体积为________。
一定条件下,可逆反应A2+B2 2C达到了化学平衡状态,经测得平衡时c(A2)="0.5" mol·L-1,c(B2)="0.1" mol·L-1,c(C)="1.6" mol·L-1。若A2、B2、C的起始浓度分别用a mol·L-1、b mol·L-1、c mol·L-1表示,请回答:
2C达到了化学平衡状态,经测得平衡时c(A2)="0.5" mol·L-1,c(B2)="0.1" mol·L-1,c(C)="1.6" mol·L-1。若A2、B2、C的起始浓度分别用a mol·L-1、b mol·L-1、c mol·L-1表示,请回答:
(1)a、b应满足的关系是_______________。
(2)a的取值范围是___________。