运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用。
①下图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水。在25°C下,将m mol·L-1的氨水与n mol·L-1的盐酸等体积混合,反应后的溶液呈中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含m和n的代数式表示出混合液中氨水的电离平衡常数表达式 。
(2)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。
25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入适量0.1mol·L-1的NaI溶液,振荡、静置,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时 )
)
(1)普通锌锰干电池的结构如图所示。回答下列问题。
①电池中电解质溶液为________。
②正极反应式为________。
③放电时,NH4+向________(填“正极”或“负极”)移动。
(2)废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是________,原因是________________________。
若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是________(填序号)。
| A.微热 |
| B.加入适量氧化铜 |
| C.加入少量硫酸铜溶液 |
| D.加水 |
E.加入少量氢氧化钡溶液
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni—Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是________(填字母序号)。
①以上反应是可逆反应 ②以上反应不是可逆反应 ③充电时化学能转变为电能 ④放电时化学能转变为电能
| A.①③ | B.②④ |
| C.①④ | D.②③ |
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明,一节废镍镉电池可以使1 m2面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重,这是因为______________________。
(3)另一种常用的电池锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电能)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年,它的负极由金属锂制成,电池总反应可表示为Li+MnO2=LiMnO2。
试回答:锂电池比容量特别大的原因是___________________________。
锂电池中的电解质溶液需用非水溶液配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因:___________________________________________________。
为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图:
回答下列问题:
(1)根据原电池原理填写下表:
| 装置序号 |
正极 |
负极反应式 |
阳离子移动方向 |
| 甲 |
|||
| 乙 |
|||
| 丙 |
|||
| 丁 |
|||
| 戊 |
(2)电极类型除与电极材料的性质有关外,还与________有关。
(3)根据上述电池分析,负极材料是否一定参加电极反应?_____
(填“是”“否”或“不一定”),请举例说明:__________________________________________。
(4)指出下列电池的放电过程中,电解质溶液酸碱性的变化:甲_______,丙_______,戊_______。(填酸性或碱性增强或减弱)
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验用品:电极________、________、稀硫酸、________(填写所缺的实验用品)、耳机(或者电流计)。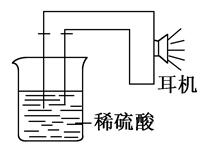
(3)实验装置:
(4)原电池设计及注意的问题。
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓”声音。其原因是:在原电池中,由化学能转化为________。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的______
极,电极反应是________________;另一极应该接电流计的________极,电极发生了________反应(“氧化”或“还原”)。
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。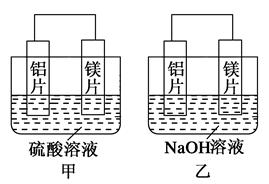
(1)写出甲中正极的电极反应式_____________________________。
(2)乙中负极为________,总反应的离子方程式:
______________________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强。(填写元素符号)
(4)由此实验得出的下列结论中,正确的有________。
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |