某烃A与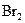 发生加成反应,生成二溴衍生物B;用加热的NaOH乙醇溶液处理B得到化合物C;经测试知C的分子中含有两个双键,分子式为
发生加成反应,生成二溴衍生物B;用加热的NaOH乙醇溶液处理B得到化合物C;经测试知C的分子中含有两个双键,分子式为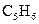 ;将C催化加氢生成环戊烷。试写出A、B、C的结构简式。
;将C催化加氢生成环戊烷。试写出A、B、C的结构简式。
(1)A.___ _____、B.__ ______、C._____ ___。
(2)写出由B得化合物C的反应方程式 ;该反应的反应类型是 反应
(3)已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:2CH3CH2Br + 2Na → CH3CH2CH2CH3  + 2NaBr应用这一反应,下列所给化合物中可以与钠合成环丁烷的是:
+ 2NaBr应用这一反应,下列所给化合物中可以与钠合成环丁烷的是:
A.CH3Br B.CH3CH2CH2CH2Br C.CH2BrCH2CH2Br D.CH2BrCH2CH2CH2Br
【化学 ——选修3:物质结构】
氮元素可形成卤化物、叠氮化物及络合物等。
(1)NF3构型为三角锥形,沸点为-129 ℃;可在铜 催化作用下由F2和过量NH3反应得到。NF3属于________晶体.
催化作用下由F2和过量NH3反应得到。NF3属于________晶体.
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N。
①与N互为等电子体的分子、离子有______、________(各举1例),由此可推知N的空间构型是______形。
②叠氮化物、氰化物能与Fe3+、Cu2+及Co3+等形成络合物,如Co[(N3)(NH3)5]SO4、[Fe(CN)6]4-。写出钴原子在基态时的价电子排布式:__________。如Co[(N3)(NH3)5]SO4、中钴的配位数为________,CN-中C原子的杂化类型是________。
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)===2Na(l)+3N2(g),有关说法正确的是________(选填序号)。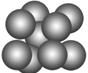
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.第一电离能(I1):N>P>S |
| C.钠晶胞结构如图,该晶胞分摊2个钠原子 |
| D.常温下,氮气很稳定,是因为氮的电负性小 |
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: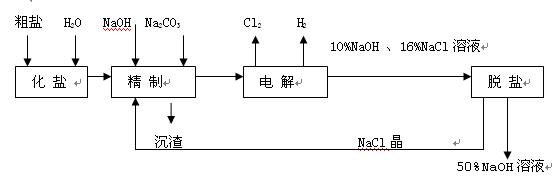
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为,与电源负极相连的电极附近,溶液pH值(选填:不变、升高或下降)
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为,
(3)为有效除去Ca2+、Mg2+、SO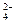 ,加入试剂的合理顺序为(选填a,b,c多选扣分)
,加入试剂的合理顺序为(选填a,b,c多选扣分)
a先加NaOH,后加Na2CO3,再加钡试剂
b先加NaOH,后加钡试剂,再加Na2CO3
c先加钡试剂,后加NaOH,再加Na2CO3
(4)脱盐工序中利用NaoH和NaCl在溶解度上的差异,通过、冷却、(填写操作名称)除去NaCl
(5)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为
A、B、C、D均为短周期的非金属元素,且原子序数依次增大。A、B可形成一种极易溶于水的碱性气体X,A、B、C元素可组成离子晶体,该晶体的化学式为A4B2C3;A和D可形成极易溶于水的酸性气体Y,X分子比Y分子少8个电子
(1)请写出四种元素的元素符号:AB CD
CD
(2)用离子方程式表示A4B2C3的水溶液显酸性的原因
(3)用电子式表示B2用电子式表示ADC
对一份稀溶液作初步分析后发现,溶液无色、澄清,其可能含有SO、Na+、CO、H+ 、NO、HCO、Cl-等离子中的若干种。然后又作了如下分析,以确定这些离子是否大量存在。
、NO、HCO、Cl-等离子中的若干种。然后又作了如下分析,以确定这些离子是否大量存在。
①用石蕊试液检测该溶液时,溶液显红色。
②取2 mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。
③对②中所得的混合物充分静置后,取其上层澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀。
请回答下列问题:
(1)原溶液中一定存在的离子是__________,一定不存在的离子是____________。
(2)在上述实验操作中,有错误的步骤是(填代号)______。对该错误改正的方法是(要作较详细的说明)_______________________________________________ ___。
___。
(3)到目前为止,不能肯定在原溶液中是否存在的离子是____________。
(6分)除去下列物质中的杂质(括号中的物质为杂质),请填表中空白处:
| 物质 |
加入试剂 |
离子方程式 |
| KCl(K 2CO 3) |
||
| FeCl 3(FeCl 2)溶液 |
||
| FeSO 4 (CuSO 4) 溶液 |