有以下一系列反应,终产物为乙二醛。
已知B的相对分子质量比A的大79,请回答:
(1)写出结构简式:A ; E 。
(2)写出B转化为C的化学方程式_______ __________
X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期。X 元素形成的单质是自然界中含量最多的气体,1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L。W的原子最外层电子数与核外电子总数之比为3:8,X的原子序数是Z的原子序数的一半。
(1)Y在周期表中的位置是__________________;X的氢化物与P的氢化物接近时的现象是_________.。
(2)W与P可形成一种个数比为1:2的化合物的电子式是___________________________。
(3)Y与P形成的化合物溶液显___性;用离子方程式表示显示这种性质的原因是_________________。
(4)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是__________________;
(5)X的三氟化物是微电子工业中优良的等离子刻蚀气体,但是在潮湿的环境中能够与水发生反应生成无色气体,遇到空气变为红棕色。写出此三氟化物与水反应的化学方程式_________________;若0.6mol的X的三氟化物完全与水反应,则转移的电子总数约是____________个。
氢气、纳米技术制成的金属燃料、非金属固体燃料已应用到社会生活和高科技领域。(1)已知短周期金属元素A和B,其单质单位质量的燃烧热大,可用作燃料。其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
899.5 |
1757.1 |
14848.7 |
21006.6 |
| B |
738 |
1451 |
7733 |
10540 |
①根据上述数据分析, B在周期表中位于区,其最高价应为;
②若某同学将B原子的基态外围电子排布式写成了ns1np1,违反了原理;
③B元素的第一电离能大于Al,原因是;
( 2 )氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由
。
②C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子相对稳定结构,则C60分子中σ键与π键的数目之比为。
A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外能层电子数比K层多2个,而C原子核外的最外能层电子数比次外层电子数少2个。
(1)它们的元素符号分别为:A;B;C;
(2)BC2是由键组成的(填“极性”或“非极性”)分子。
(3)画出C原子的核外电子排布图。
(4)A2C和BC2的空间构形分别是和。
二氧化硅晶体是立体的网状结构。其晶体模型如图所示。认真观察晶体模型并回答下列问题: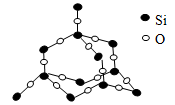

(1)二氧化硅晶体中最小的环为元环。
(2)每个硅原子为个最小环共有。
(3)每个最小环平均拥有个氧原子。
FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
1.实验需要90mL 0.1mol/L FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是、
(2)下列有关配制过程中说法错误的是(填序号)。
A用电子天平称量质量为1.944g的FeBr2.
B将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
C洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
D.容量瓶贴签存放配好的FeBr2溶液
E.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II. 探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;假设2:Fe2+被Cl2氧化成Fe3+。
(1)请你完成下表,验证假设:
| 实验步骤、预期现象 |
结论 |
| ①溶液中加入适量四氯化碳, |
假设1正确 |
| ②向溶液中加入 |
假设2正确 |
若假设1正确,从实验①中分离出Br2的实验操作名称是 ____________;
(2)实验证明:还原性Fe2+> Br-,请用一个离子方程式来证明: _________________;
(3)若在50mL上述FeBr2溶液中通入5×10-3molCl2,反应的离子方程式为。