Ⅰ.某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00mL某品牌食用白醋于烧杯中,稀释并转移至250mL容量瓶中,定容,摇匀。取稀释液25.00mL用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)该小组用酚酞试液作指示剂,判断到达滴定终点的实验现象是: 。
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。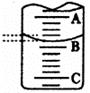
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为25.00mL,NaOH标准液浓度为cb mo1/L,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/mL |
26.32 |
25.34 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
| A.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| B.盛装标准液的滴定管装液前用蒸馏水洗后,未用标准液润洗 |
| C.第一次滴定用的锥形瓶用白醋润洗 |
D.该NaOH标准液保存时间过长,有部分变质,浓 度降低 度降低 |
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= 。
Ⅱ. 用中和滴定法测定NaOH和Na2CO3混合溶液中的NaOH的质量分数时,可先在混合溶液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞做为指示剂)。试回答:
(1)向混有BaCO3沉淀的NaOH溶液里滴加盐酸,为什么不会使BaCO3溶解而能测定NaOH溶液的质量分数?
(2)分析在滴定过程中不断振荡锥形瓶的原因?
(3)滴定终点时溶液颜色如何变化?
(4)能否改用甲基橙作指示剂?并说明理由。
在题后横线上简要说明不正确使用化学仪器可能造成的不良后果。
(1)把容器放在桌上使劲塞进塞子:______________________________________________。
(2)加热盛有碱式碳酸铜的试管,试管外壁有水:__________________________________。
(3)将加热后的蒸发皿直接放在实验台上:________________________________________。
(4)加热液体时,试管口朝着有人的方向:________________________________________。
实验室要配制2.0 mol·L-1 KNO3溶液100 mL,不使用的化学仪器是()
①烧杯②250 mL容量瓶③100 mL容量瓶④玻璃棒⑤胶头滴管⑥托盘天平
| A.只有② | B.②⑥ | C.①③ | D.①④ |
普利斯特里(Joseph Priestley)在拉瓦锡之前发现了氧气,但由于受“燃素说”的影响,他把氧气当作了“燃素”。拉瓦锡正是在普利斯特里研究的基础上,破除了“燃素说”的束缚,确认氧气是由一种元素形成的纯净物。普利斯特里在一次加热浓硫酸的实验中,由于不慎,造成了倒吸,将水槽中的水银(Hg)倒吸进加热后的浓硫酸中,并且烧坏了手。偶然中他发现热的浓H2SO4与水银发生了反应并生成了一种气体。这种气体就是由他发现的SO2。根据以上叙述判断下列说法不正确的是()
| A.浓H2SO4具有强腐蚀性,操作应格外小心 |
| B.为防止倒吸,实验结束时应先从水槽中取出导气管,后撤酒精灯 |
| C.实验中应仔细观察,不放过任何异常现象 |
| D.普利斯特里是一位失败的科学家,不值得尊敬 |
某同学在实验室发现两瓶白色固体,一瓶是硫酸钠,另一瓶是碳酸钠,但均已失去标签。下面是该同学检验这两瓶固体的方法,其中不能成功检验出硫酸钠和碳酸钠的是()
| A.分别取固体少许加入试管中,配成溶液,然后滴加氯化钡溶液 |
| B.分别取固体少许加入试管中,配成溶液,然后滴加氯化钡溶液,最后滴加盐酸 |
| C.分别取固体少许加入试管中,配成溶液,然后滴加盐酸,最后滴加氯化钡溶液 |
| D.分别取固体少许加入试管中,配成溶液,然后滴加盐酸酸化的氯化钡溶液 |
2006年6月1日讯中共中央政治局常委、国务院总理温家宝近日就2006年环保专项行动作出重要批示,部署2006年整治违法排污企业保障群众健康环保专项行动。水、大气、土壤等污染日益严重,重金属、有毒化学物质和持久性有机物等污染持续增加。一些地方已经喝不到干净的水,呼吸不到清洁的空气,土壤污染严重危及农产品安全。环境污染和生态破坏造成了巨大经济损失,严重危害群众健康,成为人民群众的切肤之痛。环境污染问题是举世瞩目的社会热点问题,下列收集气体的方法既能达到收集目的又符合环保要求的是()
A.用如图所示的方法收集二氧化硫(二氧化硫的密度比空气大)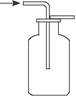 |
B.用下图所示的方法收集二氧化氮(已知:二氧化氮的密度比空气的密度大、有毒但能溶于氢氧化钠溶液)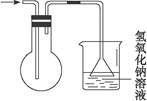 |
C.用右图所示的方法收集一氧化碳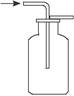 |
D.用右图所示的方法收集氢气 |