常温下,甲、乙两杯醋酸的稀溶液,甲的pH=2,乙的pH=3,对下列叙述的判断不正确的是
| A.甲中水电离出的H+的物质的量浓度是乙中水电离出的H+的物质的量浓度的1/10 | |
| B.物质的量浓度c(CH3COOH)甲>10c(CH3COOH)乙 | |
| C.中和等量NaOH溶液需甲乙两杯醋酸溶液的体积:10V(CH3COOH)甲>V(CH3COOH)乙 | D.甲中的c(OH-)为乙中c(OH-)的1/10 |
合金有许多特点,如Na—K合金为液体,而Na和K的单质均为固体。据此,试推测生铁、纯铁、碳三种物质中,熔点最低的是
| A.纯铁 | B.生铁(Fe、C的合金) | C.碳 | D.无法确定 |
下列物质中分子间能形成氢键的是
| A.N2 | B.HBr | C.NH3 | D.H2S |
下面的排序不正确的是
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.熔点由高到低:Na>Mg>Al | D.晶格能由大到小:NaF> NaCl> NaBr>NaI |
实验室常用硫酸铜溶液吸收气体中的硫化氢:CuSO4+H2S=CuS↓+H2SO4,该反应可以推测
| A.CuS易水解 |
| B.CuS可溶于盐酸 |
| C.相同温度下氢硫酸饱和溶液中硫离子(S2-)浓度比CuS饱和溶液中大 |
| D.强酸可以制取弱酸 |
溶液中同时存在Mg2+、Fe2+、Mn2+和Al3+四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据右表可知,下列说法错误的是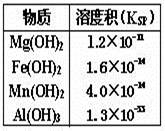
| A.Al3+最先转化为Al(OH)3沉淀 |
| B.加碱过程中,Fe2+、Mn2+几乎同时转化为沉淀 |
| C.要使Mg2+转化为沉淀,溶液pH应大于9 |
| D.pH=14时,四种金属离子全部以沉淀形式存在 |