、右图是研究外界因素对过氧化氢分解反应速率影响的实验装置图。某学生研究小组在50mL量筒中盛满水,倒置于水槽中,通过分液漏斗把过氧化氢溶液加入锥形瓶中(内中已有适量二氧化锰催化剂),记录各时间段在室温下收集到的氧气的体积。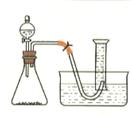
第1组:粉末状的二氧化锰0.2g+ 5ml 6% H2 O2
O2
第2组:粉末状的二氧化锰0.2g+ 3ml 12% H2O2
第3组:粉末状的二氧化锰0.1g+ 5ml 6% H2O2
第4组:颗粒状的二氧化锰0.1g+ 5ml 6% H2O2
| 催化剂:MnO2 |
第1组 |
第2组 |
第3组 |
第4组 |
| 前15s产生氧气的量(ml) |
11 |
15 |
8 |
7 |
| 前30s产生氧气的量(ml) |
21 |
24 |
11 |
9 |
| 前45s产生氧气的量(ml) |
31 |
35 |
18 |
12 |
| 前60s产生氧气的量(ml) |
45 |
48 |
26 |
15 |
(1)写出H2O2分解的反应方程式: ;
(2)从实验的几组数据中能得到的是: ;
(3)实验比较反应速率时可以测定相同时间内产生气体的体积,也可测 。
(12分)温度对化学反应速率影响的实验探究根据下图所给出的仪器和药品进行实验。
操作方法:在三支相同的试管中分别加入2 mL—3 mL约5%的H2O2,然后在每支试管中滴加2滴1 mol·L-1的FeCl3溶液后立即套上气球(大小相同)。等三支试管上的气球大小差不多相同时,同时置于三个烧杯中观察现象。
实验现象为___________________________________________________________________。
实验结论为___________________________________________________________________。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下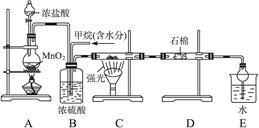
根据要求填空:
(1) B装置有三种功能:①_________________;②____________;③
________________________。
(2) 设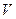 (Cl2)/
(Cl2)/ 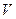 (CH4) =
(CH4) = ,若理论上欲获得最多的氯化氢,则
,若理论上欲获得最多的氯化氢,则 值的取值范围为___________。
值的取值范围为___________。
(3) D装置的石棉中均匀混有KI粉末,其作用是___________________。
(4)E装置的作用是_______________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 。
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填编号)。
A.CH4B.CH3Cl
C.CH2Cl2D.CHCl3
E.CCl4
(10分)现欲分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的名称:
(1)写出各有关物质的名称:
| A._________________, | B._________________ | C._________________, | D._________________,E._________________。 |
(2)写出加入的试剂:
a._____________,b._____________。
(3)写出有关的操作方法:
①_____________,②_____________,③_____________。
(11分)铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2
 2PbSO4+2H2O
2PbSO4+2H2O
请完成下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是__________________;电解液中H2SO4的浓度将变__________________;当外电路通过1 mol电子时,理论上负极板的质量增加_________________g。
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成_________________、B电极上生成_________________,此时铅蓄电池的正负极的极性将_________________。
下图是测定植物的某一生命活动过程的实验装置。A瓶中NaOH溶液的作用是__________________________________________________________________________,B瓶中的石灰水的作用是___________________________________________,D瓶中出现的现象是___________________________________________。此实验说明植物具有_________性质。