已知T1时反应H2(g)+I2(g) 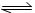 2HI(g) ; △H=-9.4 kJ/mol
2HI(g) ; △H=-9.4 kJ/mol
(1)T1时,将2 mol HI(g)通入容积为2L的容器中发生上述反应,测得T1温度时各物质的物质的量随时间的变化关系如下表:
|
0 |
2 |
4 |
6 |
8 |
10 |
||||
| H2 |
0 |
0.174 |
0.224 |
0.244 |
0.244 |
0.244 |
||||
| I2 |
0 |
0.174 |
0.224 |
0.244 |
0.244 |
0.244 |
||||
| HI |
2 |
1.652 |
1.552 |
1.512 |
1.512 |
1.512 |
①前4 min,用HI(g)表示该反应的平均速率为 ;
②T1温度下,此反应H2(g)+I2(g) 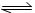 2HI(g) 的平衡常数表达式为 ;
2HI(g) 的平衡常数表达式为 ;
③10分钟后,要使HI的转化率变为10%,可能的操作是 ;
A.扩大容积 B.同时减少三种物质各0.01 mol
C.加入HI(g) 1 mol D.降低温度
(2)如图,将2 mol HI(g)和2 molBr2(g)分别通入用光滑的滑动隔板隔离的同一容器的两边。加热容器升温至T2 ,反应足够长时间后,有关说法正确的是 。
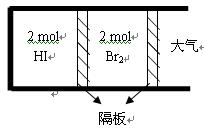
A.两边气体体积相同
B.两边气体颜色均比加热前变深
C.两边气体的平均相对分子质量均比加热前大
D.两边气体密度均比加热前减小
某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:[已知Ba(HCO3)2可溶于水]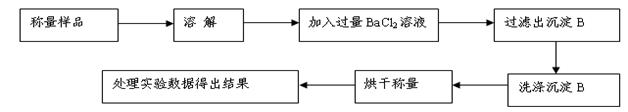
(1)实验时,过滤操作中,除了玻璃棒、漏斗外,还要用到的玻璃仪器为。
(2)洗涤沉淀B的操作是。
(3)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为____________。
方案Ⅱ.乙组同学按如下图所示装置进行实验: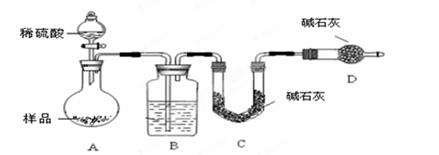
实验原理是:称量装置C吸收的CO2量来测定混合物中碳酸钠的质量分数。
主要实验流程图如下: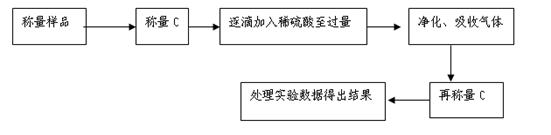
(4)该实验中装置B盛放的物质是_____________________,分液漏斗中(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(5)在C中装碱石灰来吸收净化后的气体。①样品中碳酸钠的质量分数越大,则实验中吸收净化后气体的干燥管在充分吸收气体前后的质量差____________________。(填“越大”、“越小”或“不变化”)②D装置的作用是_________________________。
(6)有的同学认为为了减少实验误差,在反应前后都要通入N2(如右图),反应后通入N2的目的是______________________________。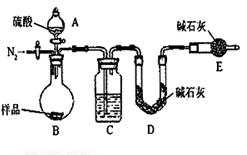
金属钒(V)在材料科学上有重要作用,被称为“合金的维生素”。在测定矿石中钒的含量时有如下操作: 用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液。
(1)完成滴定过程的离子反应方程式,方框内填数字,短线上填物质的化学式或离子符号。
VO2+ +H2C2O4 + ______→VO2+ +CO2 + ______
(2)当收集到标准状况下气体11.2升时,电子转移的数目为
(6分) 某透明澄清溶液可能含有Na+、Fe3+、Ba2+、CO32-、SO32-、SO42-、Cl-、I-等离子中的几种,为鉴别这些离子,分别取三份少量溶液,按照以下顺序进行三个实验:
实验①:加CCl4,再滴加少量氯水,振荡后,CCl4层变为紫色;
实验②:加盐酸后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
实验③:加BaCl2溶液产生白色沉淀,过滤出沉淀,在沉淀中加入足量盐酸,沉淀不能完全溶解。
(1)分析上述3个实验,用离子符号写出每一个实验得出的结论,可不必完全填满。
实验①:含有;不含;
实验②:含有;不含;
实验③:含有;不含;(可不必完全填满)
(2)通过上述实验,不能确定是否存在的离子是。
写出下列化学方程式或离子方程式。
(1)钠与氧气在常温下反应;化学方程式____________________________________。
(2)实验室多余氯气的尾气吸收;离子方程式______________________________。
(3)漂白粉的作用原理,与H2O和CO2作用;化学方程式______________________________。
(4)氢氧化铁加热分解;化学方程式________________________。
(5)次氯酸光照分解;化学方程式____________________________________。
(6)铁丝在氯气中燃烧;化学方程式__________________________________。
(7)三氯化铁溶液与铁粉反应;离子方程式________________________。
(8)新制氢氧化亚铁遇空气被氧化成氢氧化铁;化学方程式___________________________。
(9)加热碳酸氢钙溶液产生白色沉淀;化学方程式___________________________________。
(10)碳酸氢钠溶液与氢氧化钠溶液混合;化学方程式________________________________。
生态农业涉及农家肥料的综合利用。某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体8.96L(标准状况)。该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L 0.1mol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L 0.1mol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
(1) 原混合气体的物质的量是____________;生成沉淀的摩尔质量是____________。
(2) 原混合气体中甲烷的体积是____________。
(3) 求原混合气体中氮气的体积。
(第3小题请列式计算)