有A、B、C、D四种元素,它们均为主族元素,最外层电子数分别为1、4、6、7,原子序数大小为D<B<A<C。又知C元素的一种同位素原子核中有46个中子,它的最高价氧化物的式量与气态氢化物的式量之比值为1.56。
(1)A、B、C、D的元素符号分别是:
(2)写出A单质与水反应的离子方程式:
(3)写出D单质与水反应的化学方程式:
(4)写出A、B的最高价氧化物对应水化物反应的离子方程式: 。
【化学-选修5:有机化学基础】(15分)
共轭双烯与含有双键的化合物相互作用,能生成六元环状化合物。
已知反应①:
化合物Ⅱ可发生以下反应:
(1)化合物Ⅰ的分子式为_______。 1 mol该物质完全燃烧需消耗_______molO2。
(2)反应②的化学方程式为______________
(3)反应③是缩聚反应,化合物Ⅳ的结构简式为_______
(4)在一定条件下,化合物Ⅴ和化合物Ⅵ能发生类似反应①的反应,生成两种化合物(互为同分异构体),其结构简式分别为________、______
(5)下列关于化合物Ⅰ、Ⅱ、Ⅴ、Ⅵ的说法正确的有_______ (填字母)。
| A.Ⅰ属于芳香烃 |
| B.Ⅰ、Ⅱ、Ⅴ均能使溴的四氯化碳溶液褪色 |
| C.Ⅴ与足量H2加成后的产物是3—甲基戊烷 |
| D.加热条件下Ⅵ能与新制Cu (OH)2反应生成红色沉淀 |
【化学——选修3:物质结构与性质】
碳族元素C、Si、Ge的单质及其化合物在材料、医药等方面有重要的应用。请回答下列问题。
(1)Ge原子核外电子排布式为________________________。
(2)C元素的三种单质的晶体结构如图。
①金刚石晶体中碳原子与碳碳键的个数比为______;石墨晶体中碳原子的杂化类型为__________。
②石墨烯是从石墨材料中剥离出来的、由单层碳原子组成的二维晶体,每个碳原子提供一个p轨道上的电子形成大π键,π电子可以自由移动。将氢气加入到石墨烯中可制得一种新材料石墨烷。下列判断错误的是_______.
A.石墨烯是电的良导体而石墨烷则为绝缘体
B.石墨烯是一种强度很高的材料
C.石墨烯与石墨烷均为高分子化合物
D.石墨烯与H2制得石墨烷的反应属于加成反应
(3)碳元素的电负性比硅元素_______(填“大”或“小”)。CO2分子中碳氧原子之间化学键的成键方式为_________________。
(4)CO可以和很多金属形成配合物,如Ni(CO)4。
①其中Ni与CO之间的键型为_______。Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,则固态Ni(CO)4属于________晶体。
②与配体CO互为等电子体的阴离子有________(任写一种)。NH3也可作为很多配合物的配体。其中N原子的杂化类型为_____________。若配离子[Ni(NH3)6]2-为正八面体结构,则[Ni(CO)2(NH3)4]2+的结构有____________种。
【化学-选修2:化学与技术】镁合金废料回收最常用的是熔炼法,其主要工艺流程为:
废料预处理→熔化→除铁→除气和除渣→铸造。
(1)废料预处理包括粉碎、除油污和油漆。
①粉碎方法有干态机械粉碎法和湿喷机械粉碎法,其中容易造成危险的方法是,理由是。
②把油污和油漆一次性除去最适宜的方法是
A.用热碱洗涤,过滤
B.用有机溶剂溶解,过滤
C.加热气化除去
(2)镁合金在加热到935K时熔化,并不断向其中通入氩气做保护气。若液态镁与空气接触,不但会发生反应产生杂质,而且降低了镁的回收率。写出与空气的两个主要反应方程式、。
(3)向熔融镁中加入固体硼砂(B2O3)除铁,生成FeB2沉渣,写出有关的化学反应方程式。
(4)镁合金除了含有铁之外,还含有少量铝。加入C2Cl6可以除去液态镁中的氢气,还能把铝转化为Al4C3沉渣:
C2Cl6→2C+3Cl2(1)
3C+4Al→Al4C3(2)
①除气除渣炉排出的污染性气体有。
②如果1t镁合金中,铝占3.6‰,则除去铝最少需要加入C2Cl6g。
以甲烷为初始原料制取氢气,是一项比较成熟的技术,下面是制取氢气的流程图,根据信息回答下列问题: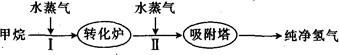
(1)阶段I发生的反应为CH4(g)+H2O(g)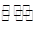 CO(g)+3H2(g)。
CO(g)+3H2(g)。
①已知在“水碳比”[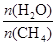 ]等于3时测得温度(T )和压强(p)对上述反应的影响如图所示。则升高温度,该反应的平衡常数K_______(填“增大”、“减小”或“不变”),据图可知p1_________(填“>”、“<”或“=”)p2。
]等于3时测得温度(T )和压强(p)对上述反应的影响如图所示。则升高温度,该反应的平衡常数K_______(填“增大”、“减小”或“不变”),据图可知p1_________(填“>”、“<”或“=”)p2。
②将等物质的量的甲烷和水蒸气充入1L恒容密闭容器中,发生上述反应,某温度下反应达到平衡,平衡常数K=27,此时测得一氧化碳的物质的量为0.10 mol,则甲烷的平衡转化率为____________。
(2)阶段Ⅱ发生的反应为CO(g)+ H2O(g)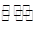 CO2(g)+ H2 (g),T1温度时,向2L的恒容密闭容器中通入一定量的CO和H2O(g),反应过程中测得部分数据如下表所示(表中t1<t2):
CO2(g)+ H2 (g),T1温度时,向2L的恒容密闭容器中通入一定量的CO和H2O(g),反应过程中测得部分数据如下表所示(表中t1<t2):
| 反应时间/min |
n(CO)/mol |
n(H2O)/mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
0.20 |
①保持T1温度不变,若向原容器中通入0.60 rnol CO和1.20 mol H2O(g),则达到平衡后n(CO2)=____。
②若达到平衡后,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是________。
a.CO的转化率将增大
b.H2O(g)的体积分数将增大
c.气体的密度将不变
d.化学平衡常数将增大
e.因混合气体总体积不变,故混合气体的总物质的量不变
(3)储氢问题是安全利用氢能的关键,某合金是一种能够吸收氢气的神奇材料,已知一定条件下1 cm3的该合金最多可吸收6.02×1022个氢原子,液态氢气的密度为0.07 g·cm-3,则相同体积的该合金和液态氢的含氢量之比为_________。
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为。
②反应B+A→C的离子方程式为。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D为(填化学式),此时图b中x 7(填“﹥”“﹤”“﹦”)
②若图c符合事实,则其pH变化的原因是(用离子方程式表示);已知图c中y﹤7,B的焰色反应为黄色,则B溶液中各离子浓度由大到小的顺序是。
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式:。