近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图14所示。(已知: )
)
①反应2NO(g) N2(g)+O2(g)为(填“吸热”或“放热) 反应。
N2(g)+O2(g)为(填“吸热”或“放热) 反应。
②一定温度下,能够说明反应2NO(g) N2(g)+O2(g)已达到平衡的是(填序号) 。
N2(g)+O2(g)已达到平衡的是(填序号) 。
a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)=CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-867kJ·mol-1
△H2= .
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NO2)转化为无毒气体,该反应的化学方程式为 。
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2 O已略去)。请填空: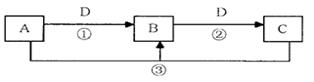
(1)若D是生产、生活中用量最大、用途最广的金属单质,加热蒸干棕黄色的B的溶液不
能得到B,则B的化学式可能是________。用有关离子方程式解释 B溶液显酸性的原因是:;
(2)若A是一种碱性气体,常用作制冷剂,B和D为空气的主要成分,则反应②的化学方程式为;
(3)若 D的氯碱
D的氯碱 工
工 业的主要产品,B有两性,则反应③的离子方程式是;
业的主要产品,B有两性,则反应③的离子方程式是;
(4)若D为酸或酸性气体,则A、C可以是,;
(5)若C是一种温室气体,D是空气的主要成分之一,1 mol黑色固体A完全燃烧放出393.5kJ热量,1 molB气体完全燃烧放出283.0kJ热量,则A→B反应的热化学方程式为。
X、Y、Z、W是周期表中原子序数依次增大的前20号元素。X、Y同周期。Y、Z同主族,Zn-与Wn+离子的电子层结构相同。由这四种元素形成的单质、化合物有如下图转化关系。已知:常温下A为液体,B、C、E、G为气态化合物,且A、C、G均为直线型分子;D是由元素W、Y形成的常见化合物。
(1)元素W的名称,A的电子式,Wn+离子的结构示意图为,F晶体中含有的化学键类型。
(2)写出D、E的化学式:D、E 。
(3)F与水反应的化学方程式:。
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同主族元素。又知B、D两元素的原子核中质子数之和是A、C两元素的原子核中质子数之和的2倍。这四种元素的单质中常温下有 两种是气体,其中一种气体易燃烧,另外两种为固体,其中一种是黄色晶体,质脆,易研成粉末。
两种是气体,其中一种气体易燃烧,另外两种为固体,其中一种是黄色晶体,质脆,易研成粉末。
⑴写出元素符号:A B C D  。
。
⑵写出两种均含A、B、C、D四种元素的化合物相互反应放出气体的化学方程式:
。
⑶用电子式表示化合物C2D形成过程  。
。
⑷用A和B两元素的单质可以制成燃料电池,电池中装有浓KOH溶液。用多孔 的惰性电极浸入浓KOH溶液中,两极均有特制的防止气体透过隔膜,在一极通入A的单质,另一极通入B的单质。写出通入B单质的一极电极反应式是: 。
的惰性电极浸入浓KOH溶液中,两极均有特制的防止气体透过隔膜,在一极通入A的单质,另一极通入B的单质。写出通入B单质的一极电极反应式是: 。
(10分) 为了防止铁被腐蚀,常在铁皮表面镀上一层较耐腐蚀的金属,如镀锌铁和镀锡铁,若罐头欲装蕃茄酱,该罐头的材料应选用上述的铁。各取一小块镀锌铁皮和镀锡铁皮,用小刀在上面刻划,露出里面的铁,然后 在刻痕上滴一滴氯化钠溶液,再滴一滴K3[Fe(CN)6]溶液(K3[Fe(CN)6]溶液遇到Fe2+会出现蓝色沉淀),静置数分钟后先出现蓝色沉淀现象的哪一块铁片?;
在刻痕上滴一滴氯化钠溶液,再滴一滴K3[Fe(CN)6]溶液(K3[Fe(CN)6]溶液遇到Fe2+会出现蓝色沉淀),静置数分钟后先出现蓝色沉淀现象的哪一块铁片?;
在铁片上发生的电极反应式为;
在另一种金属上发生的电极反应式为。
(12分)原子序数由 小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最
小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最 小的元素,Y、Z左右相邻,Z、W位于同主族。
小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是
(2)X与W组成的化合物中存在 键(填
键(填 “离子”“共价”)。
“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A。
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式:
。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
A.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
B.B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
① B的化学 式为。
式为。
②已知1 mol·L—1 100mL B的溶液能与1 mol·L—1 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式。