A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2 O已略去)。请填空: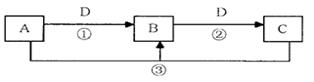
(1)若D是生产、生活中用量最大、用途最广的金属单质,加热蒸干棕黄色的B的溶液不
能得到B,则B的化学式可能是________。用有关离子方程式解释 B溶液显酸性的原因是: ;
(2)若A是一种碱性气体,常用作制冷剂,B和D为空气的主要成分,则反应②的化学方程式为 ;
(3)若 D的氯碱
D的氯碱 工
工 业的主要产品,B有两性,则反应③的离子方程式是 ;
业的主要产品,B有两性,则反应③的离子方程式是 ;
(4)若D为酸或酸性气体,则A、C可以是 , ;
(5)若C是一种温室气体,D是空气的主要成分之一,1 mol黑色固体A完全燃烧放出393.5kJ热量,1 molB气体完全燃烧放出283.0kJ热量,则A→B反应的热化学方程式为 。
下表为部分短周期元素化合价及相应氢化物沸点的数据:
| 元素性质[ |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 氢化物的沸点(℃) |
-60.7 |
-33.4 |
-111.5 |
100 |
-87.7 |
19.54 |
-84.9 |
-161.5 |
| 最高化合价 |
+6 |
+5 |
+4 |
+5 |
+7 |
+4 |
||
| 最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:
①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙。
请回答:
(1)表中属于第三周期元素的是▲(用表中元素编号填写)。
(2)写出H的最高价氧化物的电子式: ▲ ,比较A、D、G三种简单阴离子的半径大小:r( ▲ )>r( ▲ )>r( ▲ ) (均用实际的元素符号表示)
(3)由表中D元素和氢元素的原子按1:1组成的常见液态 化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________▲_________。
化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________▲_________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是:▲。
(5)工业生产强酸乙时可用纯碱溶液处理尾气,该反应如下:
BD+BD2+Na2CO3=2▲ +CO2
①横线上某盐的化学式应为 ▲ 。
②每产生44.8L(标准状况)CO2,被吸收尾气的质 量是▲g。
量是▲g。
(6)请设计一个实验方案,使得铜和稀的强酸甲反应,得到蓝色溶液和氢气,在答题卡指定位置绘出实验装置图,作出必要的说明即可。
请完成下列表格的填空:
| |
单原子分子 |
双原子分子 |
三原子分子 |
四原子分子 |
五原子分子 |
||||
| 分 子 |
He、Ne |
H2 |
HCl |
H2O |
CO2 |
BF3 |
NH3 |
CH4 |
CH3Cl |
| 键的极性 |
- |
|
|
|
|
|
|
|
|
| 键角 |
- |
- |
- |
|
|
|
|
|
|
| 空间构型 |
- |
|
|
|
|
|
|
|
|
| 分子极性 |
|
|
|
|
|
|
|
|
|
根据以上分析结果,试推测以上哪些物质易溶于水__________。
下列说法正确的是
| A.原子间的相互作用,叫做化学键 | B.两个非金属原子间不可能形成离子键 |
| C.非金属原子间不可能形成离子化合物 | D.构成分子的粒子中一定存在共价键 |
E.离子化合物中不能存在共价键 F.极性分子中不能存在非极性键
G.某化合物的水溶液能导电,则该化合物中一定存在离子键
H.两个原子形成共价键时,原子的能量将升高
某元素的原子 ,它的氯化物(MCl)1.17g溶于水形成的溶液,加入1mol/LAgNO3溶20ml恰好完全反应,若这种原子核内有12个中子
,它的氯化物(MCl)1.17g溶于水形成的溶液,加入1mol/LAgNO3溶20ml恰好完全反应,若这种原子核内有12个中子
则①Z和A的值是:,。
②请写出M元素最高价氧化物对应的水化物和与Cl元素最高价氧化物对应水化物的反应的化学方程式。
③把M的单质放入某液体中,该液体由分子构成(每个分子有三个原子核,共有十个电子)请写出有关的反应的离子方程式。
氨是一种重要的化工产品,对工业具有重要的意义。
(1)实验室收集氨气应使用法,要得到干燥的氨气可选用做干燥剂。
(2)氨气的电子式和结构式分别为:,。