下表为部分短周期元素化合价及相应氢化物沸点的数据:
| 元素性质[ |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 氢化物的沸点(℃) |
-60.7 |
-33.4 |
-111.5 |
100 |
-87.7 |
19.54 |
-84.9 |
-161.5 |
| 最高化合价 |
+6 |
+5 |
+4 |
|
+5 |
|
+7 |
+4 |
| 最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:
①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙。
请回答:
(1)表中属于第三周期元素的是 ▲ (用表中元素编号填写)。
(2)写出H的最高价氧化物的电子式: ▲ ,比较A、D、G三种简单阴离子的半径大小:r( ▲ )>r( ▲ )>r( ▲ ) (均用实际的元素符号表示)
(3)由表中D元素和氢元素的原子按1:1组成的常见液态 化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________▲_________。
化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________▲_________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是: ▲ 。
(5)工业生产强酸乙时可用纯碱溶液处理尾气,该反应如下:
BD+BD2+Na2CO3=2 ▲ +CO2
①横线上某盐的化学式应为 ▲ 。
②每产生44.8L(标准状况)CO2,被吸收尾气的质 量是 ▲ g。
量是 ▲ g。
(6)请设计一个实验方案,使得铜和稀的强酸甲反应,得到蓝色溶液和氢气,在答题卡指定位置绘出实验装置图,作出必要的说明即可。
工业上制备BaCl2的工艺流程图如下: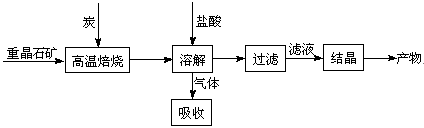
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s)△H1 ="+" 571.2 kJ·mol-1①
4CO(g) + BaS(s)△H1 ="+" 571.2 kJ·mol-1①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s)△H2=" +226.2" kJ·mol-1②
2CO2(g) + BaS(s)△H2=" +226.2" kJ·mol-1②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,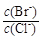 =。
=。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是,。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。

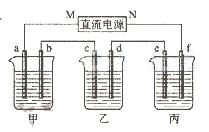
 (1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。
据此回答问题: ①电源的N端为极;
①电源的N端为极; ②电极b上发生的电极反应为;
②电极b上发生的电极反应为; ③电极b上生成的气体在标准状况下的体积:
③电极b上生成的气体在标准状况下的体积:
 ④电极c的质量变化是g;
④电极c的质量变化是g; (2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? 。
。 ⑤电解前后各溶液的pH如何变化。(填增大,减小或不变)
⑤电解前后各溶液的pH如何变化。(填增大,减小或不变) 甲溶液;
甲溶液; 乙溶液_______;
乙溶液_______; 丙溶液_______;
丙溶液_______;
25℃,NaOH和Na2CO3两溶液的pH均为11.
(1)两溶液中,由水电离出得c(H2O)分别是①NaOH中,②Na2CO3中,③在1L水中加入上述会使水的电离程度减小。
(2)各取10mL上述两种溶液,分别加水冲稀到100mL,pH变化较大的是,(填化学式)溶液。
(3)现有0.1mol/L的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是,你认为该溶液pH的范围一定介于之间。
I.按系统命名法填写下列有机物的名称或结构简式:
(1)CH3CH(C2H5)CH(CH3)CH2 CH(CH2CH3)2;
(2)2—甲基—4—乙基—3—己烯。
II.有下列各组物质
| A.S2和S4 | B.7935Br和8135Br |
| C.CH4和C8H18 | D.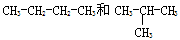 |
(E)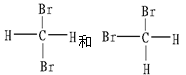
①组两物质互为同位素②组两物质互为同素异形体
③组两物质互为同分异构体④组两物质互为同系物
⑤组为同一物质
雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为。
(2)上述反应中的氧化剂是,反应产生的气体可用吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为。若将该反应设计成一原电池,则NO2应该在(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定