已知:为使Fe3+、Fe2+、Zn2+较完全的形成氢氧化物沉淀,溶液的pH应分别为3.7、9.6、4.4左右。某硫酸锌酸性溶液中含有少量Fe3+、Fe2+,为除去这些离子制得纯净的硫酸锌,应加入的试剂是( )
| A.NaOH溶液 | B.氨水 | C.KMnO4、ZnCO3 | D.H2O2、ZnO |
短周期元素X、Y、Z、W、Q在元素周期表中的位置如下表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )
| X |
Y |
||
| Z |
W |
Q |
A.W得电子能力比Q强
B.由Z与Y组成的物质在熔融时能导电
C.钠与Y可能形成Na2Y 2化合物且该化合物离子键和共价键
D.X有多种同素异形体,而Y不存在同素异形体
下列实验现象及相关结论错误的是( )
| A |
B |
C |
D |
|
| 实验 |
 |
 |
 |
 |
| 现象 |
品红褪色 |
最后试管有浅黄色沉淀 |
溶液刚出现粉红色 |
金属Ⅰ上有红色的铜析出 |
| 结论 |
SO2有漂白性 |
有机物中含有溴原子 |
滴定达到终点 |
金属Ⅱ比Ⅰ活泼 |
用碱性氢氧燃料电池为电源进行电解的实验装置图如图所示,下列说法中正确的是( )
A.燃料电池工作时,正极反应为:O2+2H2O+4e- 4OH- 4OH- |
| B.a极是碳,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.CuSO4溶液电解结束后溶液呈中性 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
对于反应CO2(g)+H2(g)  CO(g)+H2O(g) ΔH>0,在其他条件不变的情况下( )
CO(g)+H2O(g) ΔH>0,在其他条件不变的情况下( )
| A.加入催化剂,改变了反应的速率,反应的ΔH也随之改变 |
| B.降低温度,反应速率加快,反应放出的热量不变 |
| C.改变反应体系体积,平衡不发生移动,反应放出的热量不变 |
| D.若将上述反应改为在燃料电池进行,反应放出的热量不变 |
下列离子方程式与所述事实相符且正确的是( )
A.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO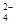 +2Ba2++4OH-===2BaSO4↓+AlO +2Ba2++4OH-===2BaSO4↓+AlO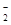 +2H2O +2H2O |
| B.稀HNO3溶液与难溶于水的FeS固体:FeS+2H+===Fe2++H2S↑ |
C.碳酸氢镁与少量澄清石灰水反应:Ca2++2OH-+2HCO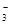 ===CaCO3↓+CO ===CaCO3↓+CO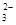 +2H2O +2H2O |
D.强碱溶液中,次氯酸钠与Fe(OH)2:3ClO-+2Fe(OH)2===2FeO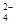 +3Cl-+H2O+4H+ +3Cl-+H2O+4H+ |