硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na 2S2O3·5H2O装置和部分操作步骤如下。
2S2O3·5H2O装置和部分操作步骤如下。
I.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
II.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
当C中溶液的pH接近7时即停止C中的反应,停止加热。
III.过滤C中的混合液。
IV.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①I中,圆底烧瓶中发生反应的化学方程式是 。
②II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 。
“停止C中的反应”的操作是 。
③III中,“过滤”用到的玻璃仪器是(填仪器名称) 。
④装置B中盛放的试剂是(填化学式) 溶液,其作用是 。
(2)依据反应2S2O32-+I2=S4O2-6+2I-,可用I2的标准溶液测定产品的纯度。取5.5g产品,配制成100mL溶液。取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/LI2的标准溶液进行滴定,相关数据记录如下表所示。
| 编号 |
1 |
2 |
3 |
4 |
| 溶液的体积/mL |
10.00 |
10.00 |
10.00 |
10.00 |
| 消耗I2标准溶液的体积/mL |
19.99 |
19.98 |
17.13 |
20.03 |
①判断达到滴定终点的现象是 。
②Na2S2O3·5H2O在产品中的质量分数是(计算结果保留1位小数) 。
(Na2S2O3·5H2O的式量为248)
Ⅰ是重要的化工原料,可发生下列反应生成Ⅲ和Ⅳ。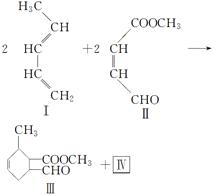
化合物Ⅰ可用石油裂解气中的2-戊烯来合成,流程如下:
CH3—CH==CH—CH2—CH3 CH2==CH—CH==CH—CH3
CH2==CH—CH==CH—CH3
(1)a的结构简式是________________;②的反应类型是____________。
(2)写出反应①的化学方程式________________,该反应类型是________。
(3)①用甲醇与某有机物发生酯化反应可合成化合物Ⅱ,写出该反应的化学方程式________________________________________________________。
②化合物Ⅱ与新制的氢氧化铜悬浊液反应的化学反应方程式为___________。
(4)化合物Ⅳ是Ⅲ的同分异构体,也有同样的六元环,Ⅳ的结构简式为______。
液晶高分子材料应用广泛。新型液晶基元——化合物Ⅳ的合成线路如下:
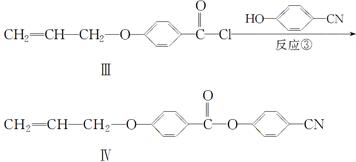
(1)化合物Ⅰ的分子式为________,1 mol化合物Ⅰ最多可与________mol NaOH反应。
(2)CH2===CH—CH2Br与NaOH水溶液反应的化学方程式为____(注明条件)。
(3)化合物Ⅰ的同分异构体中,苯环上一溴代物只有2种且能发生银镜反应的化合物有多种,写出其中一种同分异体的结构简式____________________。
(4)下列关于化合物Ⅱ的说法正确的是_______(填字母)。
| A.属于烯烃 |
| B.能与FeCl3溶液反应显紫色 |
| C.一定条件下能发生加聚反应 |
| D.能使溴的四氯化碳溶液褪色 |
(5)反应③的反应类型是________。在一定条件下,化合物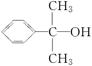 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
)已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为
_________________________________________________________________
________________________________________________________________。
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为________________________________________________________________。
(4)已知下列几种试剂:
a.无水CuSO4 b.品红溶液 c.酸性KMnO4溶液
d.澄清石灰水 e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd B.adeb C.abcbd D.abd
氨气是一种重要的工业产品,也是一种重要的化工原料。为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
(1)实验室中往往采用熟石灰与氯化铵制备氨气,写出该反应的化学方程式(注明反应条件)___________________________________________________________。
(2)实验室中还可以采用如图1装置(略去了夹持装置)和药品快速制备氨气:
①甲同学不明白该方法中制备氨气的原理,于是学习小组内成员展开了讨论,得出了下面的结论,其中不正确的是________(填字母序号)。
a.氨水中的NH3·H2O分解
b.氨水中存在可逆反应:NH3·H2O NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
c.反应原理与铵盐、熟石灰制备氨气的反应原理相同
d.NaOH溶于水放出热量,使NH3·H2O分解
②乙同学取质量分数为34%的0.89 g·mL-1的浓氨水10 mL,用过量的NaOH与之混合,然后用500 mL的烧瓶收集氨气。请你计算最多可收集满标准状况下的氨气________个烧瓶。
(3)丙同学进行氨气的喷泉实验探究。
①收集氨气时需要用干燥剂干燥,如图2,装置B中盛装的干燥剂是________。
②该同学利用图3装置,成功地完成了喷泉实验。请你简要地写出该同学操作的正确方法:__________________________________________________
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
对实验现象的“解释或结论”正确的是 ( )。
| 选项 |
实验现象 |
解释或结论 |
| A |
a处变蓝,b处变 红棕色 |
氧化性:Cl2>Br2>I2 |
| B |
c处先变红,后褪色 |
氯气与水生成了酸性物质 |
| C |
d处立即褪色 |
氯气与水生成了漂白性物质 |
| D |
e处变红色 |
还原性:Fe2+>Cl- |