氨气是一种重要的工业产品,也是一种重要的化工原料。为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
(1)实验室中往往采用熟石灰与氯化铵制备氨气,写出该反应的化学方程式(注明反应条件)___________________________________________________________。
(2)实验室中还可以采用如图1装置(略去了夹持装置)和药品快速制备氨气:
①甲同学不明白该方法中制备氨气的原理,于是学习小组内成员展开了讨论,得出了下面的结论,其中不正确的是________(填字母序号)。
a.氨水中的NH3·H2O分解
b.氨水中存在可逆反应:NH3·H2O NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
c.反应原理与铵盐、熟石灰制备氨气的反应原理相同
d.NaOH溶于水放出热量,使NH3·H2O分解
②乙同学取质量分数为34%的0.89 g·mL-1的浓氨水10 mL,用过量的NaOH与之混合,然后用500 mL的烧瓶收集氨气。请你计算最多可收集满标准状况下的氨气________个烧瓶。
(3)丙同学进行氨气的喷泉实验探究。
①收集氨气时需要用干燥剂干燥,如图2,装置B中盛装的干燥剂是________。
②该同学利用图3装置,成功地完成了喷泉实验。请你简要地写出该同学操作的正确方法:__________________________________________________
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。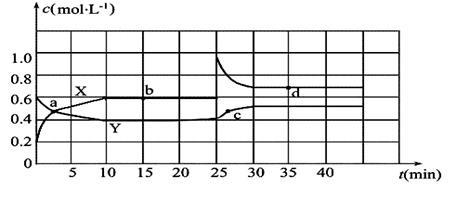
(1)图中共有两条曲线X和Y,其中曲线_______________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是______________。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=__________mol·L-1·min-1。
②0~15 min ,反应2NO2(g)  N2O4(g)的平衡常数Kb=_______________。
N2O4(g)的平衡常数Kb=_______________。
③25 min~35 min时,反应2NO2(g)  N2O4(g)的平衡常数Kd_____________Kb(填“>”、“=”或“<”)。
N2O4(g)的平衡常数Kd_____________Kb(填“>”、“=”或“<”)。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_________________(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________________。
| A.加入催化剂 | B.缩小容器体积 |
| C.升高温度 | D.加入一定量的N2O4 |
请认真观察下图,然后回答问题: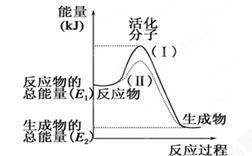
(1)图中所示反应是_______(填“吸热”或“放热”)反应,该反应的ΔH=________(用含E1、E2的代数式表示)。
(2)下列4个反应中,符合示意图描述的反应的是________。
a.盐酸与NaOH反应 b.Na与H2O反应生成H2
c.铝热反应d.灼热的碳与CO2反应
(3)途径(II)与途径(Ⅰ)相比改变的措施可能是 .
铁是当代社会中用量最大的金属之一。磁铁矿是工业上冶炼铁的原料之一,发生的主要反应为:Fe3O4(s)+4CO 3Fe(s)+4CO2
3Fe(s)+4CO2
(1)已知:①Fe3O4(s)+4C(石墨) 3Fe(s)+4CO(g) ΔH="+646.0" kJ/mol
3Fe(s)+4CO(g) ΔH="+646.0" kJ/mol
②C(石墨)+CO2(g) 2CO(g) ΔH="+172.5" kJ/mol
2CO(g) ΔH="+172.5" kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是 。
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是 (选填字母)。
a.容器内压强不再变化
b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化
d.生成CO2的速率与消耗CO的速率相等
②CO的平衡转化率是 。
③l0 min内,反应的平均反应速率v (CO2)= 。
④欲提高该反应中CO的平衡转化率,可采取的措施是 (选填字母)。
a.提高反应温度 b.移出部分CO2
c.加入合适的催化剂 d.减小容器的容积
⑤T℃时,该反应的平衡常数K= 。
下图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
(1)该反应的化学方程式为 。
(2)0~t1s 内B气体的平均反应速率为 。
(3)(t1+10)s 时,A的转化率为 ,此时v(A)正 v(B)逆(填“>”、“<”或“=”)。
(4)关于该反应的说法正确的是 。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为 。
(1)利用Zn+2FeCl3=ZnCl2+2FeCl2反应,设计一个原电池,写出电极反应式。正极 ,负极 ,电解质溶液 ,电极反应式 、 。
(2)下列操作中能使所配制的NaOH溶液浓度偏高的是
A称量的是长期暴露在空气中的NaOH
B容量瓶不干燥
C将溶解于烧杯中的NaOH溶液未经冷却就转移到容量瓶中进行配制。
D混匀容量瓶中溶液后,发现液面低于刻度线,再向容量瓶中加蒸馏水至刻度线
E.定容时,俯视液面使之与刻度线相切