下列框图中A、F、G、H都是芳香族化合物。A的相对分子质量不超过200,完全燃烧只生成CO2和H2O;A中氧元素的质量分数为8/30。
又已知:① E能发生银镜反应,G不能发生银镜反应;②F与FeCl3溶液不显紫色。
回答下列问题:
(1)下列叙述正确的是 。
(A)A的分子式是C10H14O3
(B)A能发生氧化、还原、取代、消去等反应
(C)1molA最多能与3mol H2发生加成反应
(D)A能与NaHCO3溶液反应放出CO2
(2)F分子中含有的官能团的名称是: 。
(3)由F转化成H的反应类型属于 。
(4)写出B+D→E的化学方程式: 。
(5)写出F→G的化学方程式: 。
(6)H的同分异构体甚多。请写出符合下列条件的同分异构体的结构简式(任写三种):
①苯环上只有一个链状取代基; ②能够与NaOH溶液反应。 。
写出下列转化的化学方程式,并注明反应条件和反应类型:
①(反应);②(反应);
③(反应);④(反应);
同分异构体和同系物是不同的两个概念,观察下面列出的几种物质的化学式或者结构式,然后解题。
①CO(NH2)2②NH4CNO③CH3CH2CH3④CH3CH2CH2CH3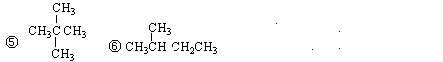
其中:(1)互为同分异构体的是;(2)互为同系物的是;
某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子。乙厂的废水中含有另外三种离子。
对于该两厂的废水,可采取下列两种方法来处理。
(1)如果在某厂的废水中加一定量(选填:活性炭或铁粉),可以回收其中的金属
(填写金属的元素符号),其反应的离子方程式是。
(2)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式:;。
经过滤后的废水主要含(填化学式),可用来浇灌农田。
无机化合物可根据其组成和性质进行分类
(1)下图所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
| 物质 类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学 式 |
①HCl ②____ |
③____ ④Ba(OH)2 |
⑤Na2CO3 ⑥____ |
⑦CO2 ⑧Na2O |
(3)写出⑦转化为⑤的化学方程式______________________________________________。
(4)实验室制备⑦常用________和________反应,检验该气体的方法是________________。
(10分)在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________
(2)A的转化率为_________________
(3)生成D的反应速率为_________________
(4)如果增大反应体系的压强,则平衡体系中C的质量分数_________(填变大、变小、不变)
(5)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各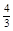 mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol
mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol