某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子 。乙厂的废水中含有另外三种离子。
对于该两厂的废水,可采取下列两种方法来处理。
(1)如果在某厂的废水中加一定量 (选填:活性炭或铁粉),可以回收其中的金属
(填写金属的元素符号),其反应的离子方程式是 。
(2)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式: ; 。
经过滤后的废水主要含 (填化学式),可用来浇灌农田。
哈伯因为氨气的合成曾获1918年诺贝尔奖。
(1)写出实验室由氯化铵和熟石灰加热制取氨气的化学方程式:。检验氨气已装满的方法是:用_____________试纸靠近集气瓶口,现象为_________________。
(2)用图装置进行喷泉实验, 若加入酚酞,得到红色喷泉,若要得到蓝色喷泉呢,应加入酸碱指示剂。
(3)完成氨催化氧化生成为NO的反应方程式,4NH3+O2="==4NO" + 6,产物NO能在通常状况下被空气氧化为NO2,请完成下列反应生成硝酸的化学方程式:
4NO+O2+2H2O="==" 4HNO3
NO2+O2 +H2O="==" 4HNO3
(4)1.28 gCu与足量的浓硝酸反应生成的气体与一定量的O2混合,然后通入水中恰好完全反应无气体剩余,则该氧气的物质的量为mol.
(1)工业上生产玻璃、水泥都要用到的原料是。(选填石灰石、粘土、石英、石膏)
(2)漂白粉由氯气和石灰乳反应生成,其有效成分是。(填化学式)
(3)测定硅铁合金中硅的含量可以有两种方法,其一是将合金粉末加入足量的稀硫酸中,其二是将合金粉末加入足量的中,都可以通过收集生成气体并测定其体积数据而确定硅含量。写出第二种方法的反应离子方程式。
选用一种试剂除去下列物质中的杂质(括号中为杂质),并写出其化学方程式或离子方程式。可供选用的试剂:
| A.氢氧化钠溶液 | B.水 | C.二氧化碳气体 | D.铁粉E铜粉,(题中填入试剂代号) |
(1)Na2CO3 (Na2O2) 除杂剂,化学方程式;
(2)FeCl2溶液(FeCl3) 除杂剂,离子方程式;
(3)Fe粉(Al粉) 除杂剂,离子方程式;
(4)NO(NO2)除杂剂___________,化学方程式__________________________________。
标准状况下,有氧气和氯气组成的混合气体共500mL。通入氢气,一定条件下使它们恰好完全反应,然后加水得到250mL盐酸溶液。从中取出25mL,用25mL 0.08mol·L-1 NaOH溶液恰好中和。则
(1)盐酸溶液的物质的量浓度mol·L-1。
(2)氢气的体积为mL。
a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化: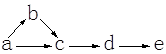
其中: a是单质;b是气体;c、d是氧化物;e是含氧酸。
(1)如果a是一种淡黄色粉末固体,试推断这五种物质(用化学式表示):
a;b;c;d;e。
(2)如果a是一种常见气体,试推断这五种物质(用化学式表示):
a;b;c;d;e。