在5 L密闭容器中加入2 mol Fe(s)与1 mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35 mol。
(1)t1~t2这段时间内的化学反应速率v(H2)= 。
(2)若继续加入2 mol Fe(s),则平衡移动 (填“向正反应方向”、“向逆反应方向”或“不”),继续通入1 mol H2O(g)再次达到平衡后,H2物质的量为 __________mol。
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件是 _________。
某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验: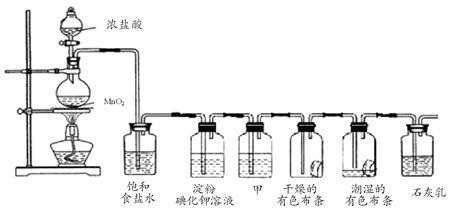
请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是 ,反应的离子方程式为 。
(2)若干燥的有色布条不褪色,潮湿的有色布条褪色,则甲中盛放 (填名称)。
(3)C12与石灰乳反应制取漂白粉的化学方程式为 。
(4)该兴趣小组用8.7g MnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl2 L。
利用化合价推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①SO2的性质________________(填序号,下同)
A.只有氧化性 B.只有还原性 C.既有还原性又有氧化性
②SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应后,锰元素被还原成Mn2+,写出上述反应的离子方程式_______________________
(2)Fe(OH)2很不稳定,露置在空气中容易被氧化,发生反应的离子方程式为_______________为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配置的NaOH溶液反应制备。
①用硫酸亚铁晶体配置上述硫酸亚铁溶液时,还需加入______________来防止Fe2+被氧化。
②除去蒸馏水中溶解的O2常采用_____________的方法
(3)检验Fe3+的方法:_______________________(写出加入试剂的化学式和现象与结论)
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)。
(1)硝酸在该反应中的作用是__________________。该反应的还原产物是________________
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________。
硝酸是一种具有强氧化性、强腐蚀性的无机酸,在储运过程中要严防泄漏。回答下列有关问题:
(1)硝酸储运罐子上应贴有的安全标识是(填序号)__________
① ②
② ③
③ ④
④
(2)一般在运输浓硝酸时采用的储藏罐材料是___________(填序号),原因是_______________。
①铁 ②铝 ③铜 ④陶瓷
(3)从硝酸泄漏现场可以看到大量的红棕色气体弥漫,该红棕色气体的成分是 。
(4)由于硝酸泄漏后与其他物质发生反应,并放出大量的热,故可在地面铺撒____________(填序号),并及时用水降温。
①氯化钙 ②氯化钠 ③生石灰 ④熟石灰
将质量为m1的NaHCO3固体用酒精灯加热一段时间后,测得剩余固体的质量为m2。
(1)发生反应的NaHCO3质量为多少?
(2)当剩余固体的质量为多少时,可以断定NaHCO3已分解完全?