利用化合价推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①SO2的性质________________(填序号,下同)
A.只有氧化性 B.只有还原性 C.既有还原性又有氧化性
②SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应后,锰元素被还原成Mn2+,写出上述反应的离子方程式_______________________
(2)Fe(OH)2很不稳定,露置在空气中容易被氧化,发生反应的离子方程式为_______________为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配置的NaOH溶液反应制备。
①用硫酸亚铁晶体配置上述硫酸亚铁溶液时,还需加入______________来防止Fe2+被氧化。
②除去蒸馏水中溶解的O2常采用_____________的方法
(3)检验Fe3+的方法:_______________________(写出加入试剂的化学式和现象与结论)
A~L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去)。已知A为金属单质,C、D通常状况下为气体单质。B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L。G和I分别由相同的两种元素组成,通常状况下均为无色液体。
(1)B的化学式为;工业上冶炼金属A的方法称为。
(2)向E的溶液中加入氢氧化钠溶液的实验现象为,反应的化学方程式为。
(3)写出E的酸性溶液与G反应转化为H的离子方程式。
(4)相同条件下物质的量浓度相同的K、L溶液的pH大小关系为KL(用“>”、“<”或“=”表示),其主要原因是(用化学用语说明)。
用8g NaOH固体配制成100mL NaOH溶液,并进行有关实验,计算并回答问题
(1)配成NaOH溶液的物质的量浓度是_____;
(2)配制溶液时需要的仪器应选择___________
① 100mL量筒②100mL烧杯③100mL容量瓶④胶头滴管⑤玻棒
(3)将所得溶液与一定质量的铝充分反应,铝全部反应完,生成的气体在标准状况下体积为3.36L。铝的质量______g。
(4分)分别只用一种试剂除去下列各组中所含的少量杂质(括号内为杂质),在空格中填上需加入的一种试剂
(1)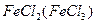 ,(2)SO2(H2O) ,
,(2)SO2(H2O) ,
(3分)治理汽车尾气中的NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使NO和CO反应生成两种空气中的无毒害气体,写出化学方程式__________________________________1mol的NO参加反应转移电子数为___________
(8分)蛇纹石由MgO、A12O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸使之充分反应,过滤后,得沉淀X和溶液Y,分别向沉淀X和溶液Y中加 入NaOH溶液至过量。
入NaOH溶液至过量。
(1).蛇纹石成分中是碱性氧化物有__________,是两性氧化物的有_____。
(2) 沉淀X与NaOH溶液的离子方程式_______________________
(3)溶液Y中加入NaOH溶液有沉淀生成,再继续加NaOH溶液有部分沉淀溶解,沉淀溶解的离子方程式___________________
(4)检验蛇纹石固体成分中含有Fe2O3,应选择的试剂和方法_______
A、用NaOH溶液溶解,观察到红褐色沉淀
B、加入KSCN溶液溶解,能观察到红色沉淀生成
C、用稀硫酸溶解,加KSCN溶液后溶液变血红色