(1)相同物质的量的CO2和O2,原子数目之比为 ,氧原子数目之比为 ;质量相同的CO2和O2,其物质的量之比为 。
(2)20.6 g NaR含有Na+0.2 mol,则NaR的摩尔质量为 g·mol-1,则含R 8.0 g的NaR的物质的量为 mol。
【化学—有机化学基础】
肉桂酸甲酯(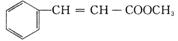 )又称苯基丙烯酸甲酯,具有可可香味,主要用于日化和食品工业,是常用的定香剂或食用香精,同时也是重要的有机合成原料。
)又称苯基丙烯酸甲酯,具有可可香味,主要用于日化和食品工业,是常用的定香剂或食用香精,同时也是重要的有机合成原料。
(1)有关肉桂酸甲酯的叙述中,正确的是(填标号)。
A.肉桂酸甲酯的摩尔质量为163g/mol B.无法使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应 D.能发生加聚反应生成高分子化合物
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示(图中球与球之间连线表示单键或双键)。G的结构简式为。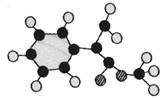
(3)用芳香烃A为原料合成G的路线如下:
①化合物E中的官能团有(填名称)。
②B→C该反应的化学方程式为:。
③A→B、E→F的反应类型是、。
④符合下列条件的F的同分异构体的结构简式是。
a.分子内含苯环,且苯环上只有一个支链;
b.在一定条件下,lmol该物质与足量银氨溶液充分反应,生成4mol银单质。
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,用作杀菌剂、防腐剂、解酸剂、油类漂白剂及封闭胶泥的快干剂,在食品、牙粉、化妆品等制造中用作添加剂。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
请回答下列问题:
(1)操作①中应包括、、用氨水调节pH至8~9的目的是______________。
(2)若测得滤液C中c(CO )=2.50×10-4 mol·L-1,则Ca2+______(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
)=2.50×10-4 mol·L-1,则Ca2+______(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH )c(NO
)c(NO ) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为。
) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式:_______________,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9~11的原因_________________________。
(5)写出CaO2与H2O反应的化学方程式。
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g)  CO(g) +H2(g)ΔH=" +131.3" kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施加快反应速率且有利于提高H2O的平衡转化率的是。(填序号)
CO(g) +H2(g)ΔH=" +131.3" kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施加快反应速率且有利于提高H2O的平衡转化率的是。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO E.增大压强 |
(2)又知,C(s)+ CO2(g) 2CO(g) △H=+172.5kJ•mol-1
2CO(g) △H=+172.5kJ•mol-1
写出C(s)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式。
(3)甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池负极反应式为:。
若用该电池提供的电能电解600mLNaCl溶液,设有0.01molCH3OH完全放电,NaCl足量,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)  CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
| 温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所x需时间/min |
||
| H2O |
CO |
H2 |
CO |
||
| 900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字) 。
改变反应的某一条件,反应进行到tmin时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 4.5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g)ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g)ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
不同实验条件下反应,N2浓度随时间变化如下图1。

图1图2
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
(1)人们常用催化剂来选择反应进行的方向。图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
①若要使CH3OH与O2反应主要生成HCHO,则应选择 (有催化剂或无催化剂)条件。
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g)△H= 。
③在稀硫酸催化下,甲醛、乙醛等简单醛可以通过反应生成环状聚合物。写出三聚乙醛(六元环)的结构简式: 。
④甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,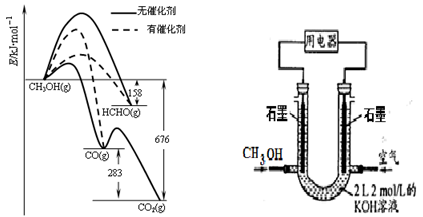
写出该反应的离子方程式: 。
(2)某兴趣小组利用甲醇设计成燃料电池图,通入甲醇的物质的量为n(CH3OH)。
①当0<n(CH3OH)≤2mol 时,电池反应式为
②当n(CH3OH)="3mol" 时,溶液中离子浓度的大小关系为
③当3mol<n(CH3OH) ≤4mol 时,负极反应式为
[物质与结构]纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
(1)某同学根据上述信息,推断B的基态原子核外电子排布如图所示,该同学所画的电子排布图违背了。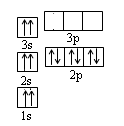
(2)ACl2分子的空间结构为(用文字描述)。
(3)我国部分城市雾霾天占全年一半,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,其中NO3-中N原子的杂化方式是,与SO42-互为等电子体的分子是。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其
晶胞如图所示,该物质在低温时是一种超导体。该物质的化学式
为。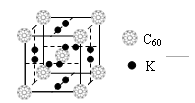
(5)继C60后,科学家又合成了Si60、N60, Si60分子中每个硅原子只跟相 邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为。